
科目: 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]比FeSO4稳定,不易被氧气氧化,常用于代替FeSO4作分析试剂。某小组尝试制备少量(NH4)2Fe(SO4)2·6H2O并探究其分解产物。

I.制备硫酸亚铁铵晶体的流程如下:
(1)铁屑溶于稀硫酸的过程中,适当加热的目的是_________。
(2)将滤液转移到_________中,迅速加入饱和硫酸铵溶液,直接加热蒸发混合溶液,观察到_________停止加热。蒸发过程保持溶液呈较强酸性的原因是_________。
Ⅱ.查阅资料可知,硫酸亚铁铵晶体受热主要发生反应:
____(NH4)2Fe(SO4)2·6H2O=____Fe2O3+____SO2↑+____NH3↑+____N2↑+____H2O
但伴有副反应发生,生成少量SO3和O2。设计以下实验探究部分分解产物:
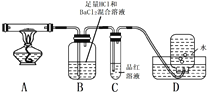
(3)配平上述分解反应的方程式。
(4)加热过程,A中固体逐渐变为_______色。
(5)B中迅速产生少量白色沉淀,反应的离子方程式为______。
(6)C的作用是_________。
(7)D中集气瓶能收集到O2,____ (填“能”或“不能”)用带火星木条检验。
(8)上述反应结来后,继续证明分解产物中含有NH3的方法是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在25 ℃时,向100 mL含14.6 g氯化氢的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则:
(1)在前2 min内用FeCl2表示的平均反应速率是_____________________________。
(2)在后4 min内用HCl表示的平均反应速率是______________________________。
(3)前2 min与后4 min相比,反应速率较快的是_________,其原因是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验操作,现象和解释或结论都正确的是
| 操作 | 现象 | 解释或结论 |
A | 向某溶液中通入Cl2,再加入CCl4、振荡,静置 | 溶液分层,上层呈紫色 | 说明溶液中含有I- |
B | 向Fe(NO3)2溶液加入盐酸酸化的KSCN溶液 | 溶液变成血红色 | Fe(NO3)2已经变质 |
C | FeCl3溶液加入过量的KI溶液,再加入KSCN溶液 | 溶液变成血红色 | Fe3+与I-反应为可逆反应 |
D | 向玻璃片上分别滴几滴氢氟酸和NaOH溶液 | 玻璃片慢慢被腐蚀 | SiO2是两性氧化物能与酸、碱反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下,硫化物的沉淀在溶液中达溶解平衡时,金属阳离子的浓度随S2-浓度的变化曲线如图所示。据图判断,下列说法错误的是 ( )
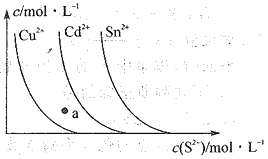
A.三种物质的溶度积大小为Ksp(CuS)<Ksp(CdS)<Ksp(SnS)
B.向SnS悬浊液中加入少量CuSO4固体,c(Sn2+)会减少
C.a点无CdS沉淀产生
D.向含等物质的量浓度的Cu2+、Sn2-的混合液中,滴加Na2S溶液,先析出CuS沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚被称为“21世纪的清洁燃料”。利用甲醇脱水可制得二甲醚。反应方程式如下:2CH3OH(g)≒CH3OCH3(g)+H2O(g) ΔH1
(1) 二甲醚亦可通过合成气反应制得,相关热化学方程式如下:2H2(g)+CO(g)≒CH3OH(g) ΔH2
CO(g)+H2O(g)≒CO2(g)+H2(g) ΔH3 3H2(g)+3CO(g)≒CH3OCH3(g) +CO2(g) ΔH4
则ΔH1=__________________(用含有ΔH2、ΔH3、ΔH4的关系式表示).
(2)经查阅资料,上述甲醇脱水反应平衡常数Kp的计算式为lnKp= - 2.205+(2708.6137/T) (Kp为以分压表示的平衡常数,T为热力学温度),且催化剂吸附H2O(g)的量会受压强影响,从而进步影响催化效率。
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为CH3OCH3(g)的倾向__________ (填“增大”、“不变”或“减小”),ΔH4________2ΔH2+ΔH3 (填“>”、<”或“=”)。
物质 | CH3OH | CH3OCH3 | H2O |
分压/MPa | 0.50 | 0.50 | 0.50 |
②某温度下(此时Kp=100),在密闭容器中加入一定量CH3OH,某时刻测得各组分的压如下:
此时正、逆反应速率的大小:V正____V逆(填“>”、“<”或“=”)。

③200℃时,在密闭容器中加入一定量CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为__________(填序号).
A.< 1/3 B.1/3 C.1/3~1/2 D.1/2 E.> 1/2
④300℃时,使CH3OH(g)以一定流速通过催化剂,V/F(按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请简述在上述条件下,压强对甲醇转化率影响的规律,并解释变化原因__________。
(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①负极的电极反应式为__________。
②现利用该电池电解CuC12溶液,当消耗2.3g二甲醚时,电解所得铜的质量为_________g(设电池的能量利用率为50%)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的定容容器中,反应:A(s)+2B(g)![]() C(g) +D(g)。下列不能表明反应
C(g) +D(g)。下列不能表明反应
达到平衡状态的是( )。
A.气体的压强不变B.气体平均相对分子质量不变
C.气体的密度不变D.B物质的量浓度不变
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
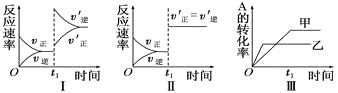
A. 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B. 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
D. 图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高
查看答案和解析>>
科目: 来源: 题型:
【题目】CO和H2在工业上常作为重要的化工原料,其混合气称为合成气。工业上CH4—H2O催化重整是目前大规模制取合成气的重要方法,其原理为:
反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1=+210 kJ/mol
CO(g)+3H2(g) H1=+210 kJ/mol
反应Ⅱ:CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=﹣41 kJ/mol
CO2(g)+H2(g) H2=﹣41 kJ/mol
(1)CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) H3=____ kJ/mol。
CO2(g)+4H2(g) H3=____ kJ/mol。
(2)反应Ⅰ达到平衡的标志是_____。
A.恒温恒容情况下,压强不再改变 B.v正(CO)=3v逆(H2)
C.平均相对分子质量不再改变 D.恒温恒容情况下,气体密度不再改变
(3)若容器容积不变,不考虑反应Ⅰ,对反应Ⅱ下列措施可增加CO转化率的是____。
A.升高温度 B.将CO2从体系分离
C.充入He,使体系总压强增大 D.按原投料比加倍投料
(4)将1 mol CH4(g)和1 mol H2O(g)加入恒温恒压的密闭容器中(温度298 K、压强100 kPa),发生反应Ⅰ,不考虑反应Ⅱ的发生,该反应中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),其中k正、k逆为速率常数,p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=___(以k正、k逆表示)。若该条件下k正=4.4×104kPa-1·s-1,当CH4分解20%时,v正=__kPa·s-1(保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是

A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由b点到c点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,可逆反应2A(g)![]() B(g)+3C(g),反应处于平衡状态的是( )
B(g)+3C(g),反应处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | v(A)=2mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
B | v(A)=2mol·L-1·min-1 | v(C)=2mol·L-1·min-1 |
C | v(A)=1mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
D | v(A)=1mol·L-1·min-1 | v(C)=1.5mol·L-1·min-1 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com