
科目: 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】25C时,0.1mol/L的3种溶液①盐酸②氨水③CH3COONa溶液。下列说法中,不正确的是
A. 3种溶液中pH最小的是①
B. 3种溶液中水的电离程度最大的是③
C. ①与②等体积混合后溶液显酸性
D. ①与③等体积混合后c(Na+)>c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】山梨酸是应用广泛的食品防腐剂,其结构如图所示,下列关于山梨酸的说法错误的是( )

A.分子式为C6H8O2
B.1mol该物质最多可与3molH2发生加成反应
C.可使酸性KMnO4溶液褪色
D.可与碳酸氢钠溶液反应生成CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:![]()
平衡Ⅱ:![]()
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mgL-1 | 72 | ≤0.5 |
NH4+/mgL-1 | 2632 | ≤15 |
下列说法错误的是( )
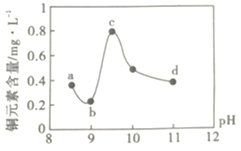
A.a~b段发生的反应为:![]()
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升
查看答案和解析>>
科目: 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O,可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,已知H2O2足量,下列说法不正确的是( )
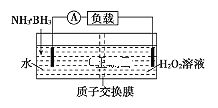
A.正极的电极反应式为3H2O2+6H++6e-═6H2O
B.H+通过质子交换膜向右侧移动
C.电池工作时,正、负极分别放出H2和NH3
D.当电路中转移0.6 NA电子,左右两极室质量差为1.9 g
查看答案和解析>>
科目: 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中混有SO3 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | AgCl悬浊液中滴入少量Na2S溶液 | 沉淀变黑色 | Ksp(Ag2S)>Ksp(AgCl) |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在平衡: I3- |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温下的密闭容器中,有可逆反应![]() ,下列不能说明该反应已达到平衡状态的是( )
,下列不能说明该反应已达到平衡状态的是( )
A.正反应生成NO2的速率和逆反应生成O2的速率
B.混合气体的颜色不再改变
C.反应容器中的压强不随时间的变化而变化
D.混合气体的平均摩尔质量保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1 mol/L,某同学进行了如下实验,下列说法正确的是

A.原溶液中存在NH4+、Fe2+、Cl-、SO42-
B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C.无法确定沉淀C的成分
D.无法确定原试液中是否含有Al3+、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:![]()
平衡Ⅱ:![]()
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mgL-1 | 72 | ≤0.5 |
NH4+/mgL-1 | 2632 | ≤15 |
下列说法错误的是( )
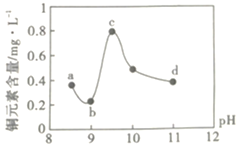
A.a~b段发生的反应为:![]()
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下,830℃时,向一个2 L的密闭容器中充入0.2 mol的A和0.8 mol的B。
C(g)+D(g)反应的平衡常数和温度的关系如下,830℃时,向一个2 L的密闭容器中充入0.2 mol的A和0.8 mol的B。
温度 | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)反应达平衡后,升高温度,平衡_______移动(填“正向”或“逆向”)
(2)830℃达平衡时,A的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com