
科目: 来源: 题型:
【题目】下列各项叙述中,正确的是( )
A.Na、Mg、Al的未成对电子数依次增多
B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C.2p和3p轨道形状均为哑铃形,能量也相等
D.氮原子的最外层电子排布图:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. 3d3表示3d能级上有3个轨道
B. ns能级的原子轨道图都可以用如图表示
C. 1s电子云呈球形,表示电子绕原子核做圆周运动
D. 电子云图的黑点密度越大,说明核外空间电子数越多
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目: 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物![]() 含
含![]() 、
、![]() ,过滤后得到的滤液用
,过滤后得到的滤液用![]() 溶液处理,测得溶液的pH和
溶液处理,测得溶液的pH和![]() 生成的量随加入
生成的量随加入![]() 溶液体积变化的曲线如下图所示。下列有关说法错误的是( )
溶液体积变化的曲线如下图所示。下列有关说法错误的是( )
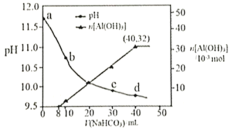
A.a点溶液中存在:![]()
B.水的电离程度:a点小于c点
C.原![]() 溶液中
溶液中![]()
D.生成沉淀的离子方程式为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,0.1 mol·L1 H2R溶液中H2R、HR、R2三者中所占物质的量分数(分布系数δ)随pH变化的关系如图所示。下列表述正确的是
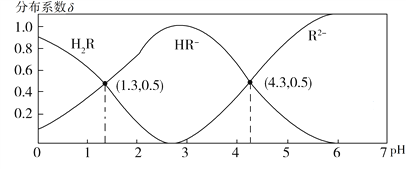
A. Na2R溶液中:c(Na+)=c(HR)+2c(R2)
B. H2R![]() H++HR,Ka1=1.0×101.3
H++HR,Ka1=1.0×101.3
C. 等物质的量的NaHR和Na2R溶于水,使得溶液pH恰好为4.3
D. HF的Ka=1.0×103.4,在足量NaF溶液中加入少量H2R,发生反应:H2R+2F![]() 2HF+R2
2HF+R2
查看答案和解析>>
科目: 来源: 题型:
【题目】美国芝加哥大学化学研究所近日揭示了WO3/CeO2-TiO2双催化剂在低温下催化氮的污染性气体转化为无毒气体,其过程如图所示
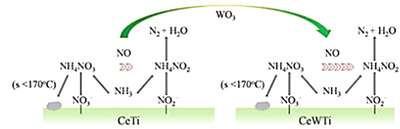
(1)Ti价电子排布式为______________,其能量最高的能层是___________。
(2)N、O、H三种原子的电负性由大到小的顺序为___________________。
(3)NO2-的空间构型为___________,与NO3-互为等电子体的分子为_______________
(4)WO3可作为苯乙烯氧化的催化剂![]() +H2O2
+H2O2![]()
![]() +H2O
+H2O
①![]() 中碳原子的杂化方式为_________。
中碳原子的杂化方式为_________。
②1molH2O2中δ键个数为____________。
③![]() 属于______________晶体。
属于______________晶体。
(5)W和Ti可形成金属互化物,某W和Ti的金属互化物如图所示,则该晶体的化学式为__________。
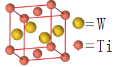
(6)金属钛的晶体堆积方式为 ____________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表示式错误的是( )
A. Na+的轨道表示式:![]() B. Na+的结构示意图:
B. Na+的结构示意图:![]()
C. Na的电子排布式:1s22s22p63s1 D. Na的外围电子排布式:3s1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列不符合节能减排要求的是( )
A.将煤块粉碎提高燃料的燃烧效率
B.在汽车上安装汽车尾气催化转化装置,可使汽车尾气中的![]() 和
和![]() 发生反应:
发生反应:![]()
C.在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢燃料电池汽车
D.在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,容积相同的两个密闭容器中,一个充入2 mol SO2、1 mol O2,另一个充入2 mol SO3,发生反应2SO2(g)+O2(g) ![]() 2SO3(g);ΔH=-196.6 kJ/mol分别达到平衡时,下列六种说法中正确的有( )
2SO3(g);ΔH=-196.6 kJ/mol分别达到平衡时,下列六种说法中正确的有( )
①二氧化硫的转化率与三氧化硫的分解率之和为1
②达到平衡所需的时间相等 ③密度相等 ④压强相等
⑤放出与吸收的热量相等 ⑥二氧化硫的浓度相同
A. 3种 B. 4种
C. 5种 D. 6种
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com