
科目: 来源: 题型:
【题目】对于苯乙烯(![]() )有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
)有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部正确
查看答案和解析>>
科目: 来源: 题型:
【题目】用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备锂电池的正极材料LiFePO4。部分工艺流程如下:
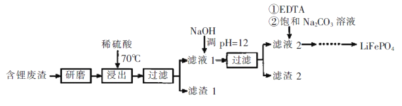
资料:i滤液1、滤液2中部分例子浓度(g·L-1)
Li+ | Ni2+ | Ca2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 0.36 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.08 | 0.78×10-3 |
ii.EDTA能和某些二价金属离子形成稳定的水溶性络合物
iii.某些物质的溶解度(S)
T/℃ | 20 | 40 | 60 | 80 | 100 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
S(Li2SO4)/g | 34.7 | 33.6 | 32.7 | 31.7 | 30.9 |
I.制备Li2CO3粗品
(1)上述流程中为加快化学反应速率而采取的措施是____。
(2)滤渣2的主要成分有____。
(3)向滤液2中先加入EDTA,再加入饱和Na2C03溶液,90℃充分反应后,分离出固体 Li2CO3粗品的操作是_______。
(4)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是________g。(摩尔质量:Li2CO3 74 g.mol4)
II.纯化Li2CO3粗品
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO31溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是____,该池使用了_________(填“阳”或“阴”)离子交换膜。
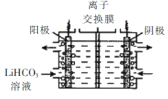
Ⅲ.制备 LiFePO4
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是熔融薄膜状的碘化锂,该电池发生的总反应为2Li+P2VP·nI2![]() P2VP·(n-1)I2+2LiI。下列说法正确的是 ( )
P2VP·(n-1)I2+2LiI。下列说法正确的是 ( )
A.该电池放电时,锂电极发生还原反应
B.该电池放电时,碘离子移向正极
C.P2VP和I2的复合物是绝缘体,不能导电,充电时与外电源的负极相连
D.放电时正极的电极反应式为P2VP·nI2+2e-+2Li+=P2VP·(n-1)I2+2LiI
查看答案和解析>>
科目: 来源: 题型:
【题目】我国航天航空事业蒸蒸日上,航天航空的关键技术是火箭,火箭燃料有液氢、乙炔![]() 、甲烷、煤油、肼
、甲烷、煤油、肼![]() 等。请回答下列问题:
等。请回答下列问题:
(1)已知肼的结构简式可表示为![]() 。
。
①肼分子中的化学键类型为 _______________________。
②肼在氧气中燃烧生成无毒的物质,则反应中肼断裂的化学键有N—H键、_______________________,新形成的化学键有_______________________ 。
③根据肼燃烧过程中的能量变化,说明反应物能量之和_______________________ (填“大于”“等于”或“小于”)生成物能量之和。
(2)氢燃料汽车中氢的燃烧与火箭中氢的燃烧最大的不同在于前者使用的是空气作氧化剂,而后者使用的是液氧。火箭中不能使用液化空气,原因是_______________________ 。
(3)火箭发射前,当液氢、液氧加到一定量后,技术人员还要不停地补加,请你说出这种做法的原因_______________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】人们将连有四个不同基团的碳原子形象地称为手性碳原子。曙红可用作指示剂及染料,其结构简式如图所示。下列有关曙红的说法正确的是 ( )
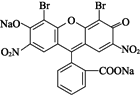
A.曙红不能与盐酸发生反应
B.1个曙红分子中含1个手性碳原子
C.1 mol曙红最多能与3 mol NaOH反应
D.曙红能发生取代、加成、消去反应
查看答案和解析>>
科目: 来源: 题型:
【题目】用零价铁![]() 去除水体中的硝酸盐
去除水体中的硝酸盐![]() 已成为环境修复研究的热点之一.
已成为环境修复研究的热点之一.
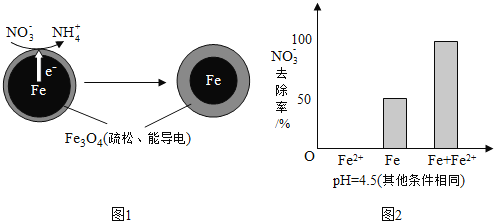
![]() 还原水体中
还原水体中![]() 的反应原理如图1所示.
的反应原理如图1所示.
①作负极的物质是______.
②正极的电极反应式是______.
![]() 将足量铁粉投入水体中,经24小时测定
将足量铁粉投入水体中,经24小时测定![]() 的去除率和pH,结果如下:
的去除率和pH,结果如下:
初始pH |
|
|
| 接近 |
|
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
![]() 时,
时,![]() 的去除率低.其原因是______.
的去除率低.其原因是______.
![]() 实验发现:在初始
实验发现:在初始![]() 的水体中投入足量铁粉的同时,补充一定量的
的水体中投入足量铁粉的同时,补充一定量的![]() 可以明显提高
可以明显提高![]() 的去除率.对
的去除率.对![]() 的作用提出两种假设:
的作用提出两种假设:
Ⅰ![]() 直接还原
直接还原![]() ;
;
Ⅱ![]() 破坏
破坏![]() 氧化层.
氧化层.
①做对比实验,结果如图2所示,可得到的结论是______.
②同位素示踪法证实![]() 能与
能与![]() 反应生成
反应生成![]() 结合该反应的离子方程式,解释加入
结合该反应的离子方程式,解释加入![]() 提高
提高![]() 去除率的原因:______.
去除率的原因:______.
![]() 其他条件与
其他条件与![]() 相同,经1小时测定
相同,经1小时测定![]() 的去除率和pH,结果如表:
的去除率和pH,结果如表:
初始pH |
|
|
| 约 | 约 |
1小时pH | 接近中性 | 接近中性 |
与![]() 中数据对比,解释
中数据对比,解释![]() 中初始pH不同时,
中初始pH不同时,![]() 去除率和铁的最终物质形态不同的原因:______.
去除率和铁的最终物质形态不同的原因:______.
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸
查看答案和解析>>
科目: 来源: 题型:
【题目】将含有C.H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗氧气的质量是多少______?
(2)求此化合物的分子式______?(要有简单计算过程)
(3)该化合物1分子中存在1个苯环和1个羟基,试写出它的同分异构体的结构简式______。(计算要有文字说明过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式。
①________,④________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(5)写出向②⑤的混合液中通入⑥的离子方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com