
科目: 来源: 题型:
【题目】请认真观察图,然后回答问题:
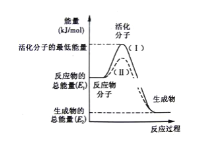
(1)图中所示反应是___(填“吸热”或“放热”)反应
(2)图中所示反应的ΔH=___(用含E1、E2的代数式表示)。
(3)下列4个反应中,符合示意图描述的反应的是____(填代号)。
A.盐酸与NaOH反应 B.Na与H2O反应生成H2
C.铝热反应 D.灼热的炭与水蒸气反应生成CO和H2
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4kJ/mol
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种,为确定其成分,完成了如下实验
中的几种,为确定其成分,完成了如下实验![]() 已知:
已知:![]()
![]() 根据实验现象,所得结论错误的是
根据实验现象,所得结论错误的是![]()
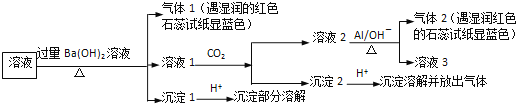
A.沉淀1加酸部分溶解,则含![]() 和
和![]()
B.可能含![]() 、
、![]()
C.沉淀2加酸溶解,则含![]()
D.气体1遇水显碱性,则含![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】检验某溶液中是否含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象。下列叙述不正确的是
,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象。下列叙述不正确的是![]()
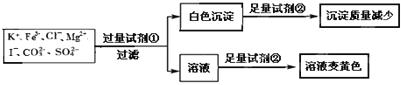
A.试剂![]() 为硝酸钡
为硝酸钡
B.试剂![]() 一定为盐酸
一定为盐酸
C.该溶液中一定有![]() 、
、![]() 、
、![]() 、
、![]()
D.通过在黄色溶液中加入硝酸银溶液可以检验原溶液中是否存在![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】铝元素含量居金属首位, 主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:
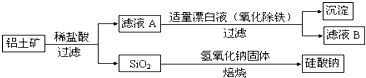
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□__________
②检验滤液B中是否还含有铁元素的方法为:_________________________
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、__________(填操作名称)、过滤、洗涤。
Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。
(1)明矾曾经是净水明星,用离子方程式表示其净水原理_____________________________。
(2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,下列溶液的有关计算。
(1)某H2SO4溶液的浓度是0.005molL-1;
①此溶液的pH=___;
②该溶液中由水电离的c(H+)为___。
③用水稀释到原来体积的100倍,pH=___。
(2)0.001mol/L的NaOH溶液, pH=___;
(3)0.015mol/L的H2SO4与0.01mol/L的NaOH等体积混合,混合液pH=___。
(4)把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则两种溶液的体积比应是___。
A.10∶1 B.1∶10 C.1∶100 D.1∶2
查看答案和解析>>
科目: 来源: 题型:
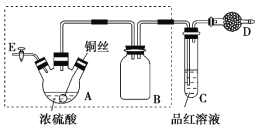
【题目】某同学对教材中铜与浓硫酸的实验作出如下改进。实验装置如图所示(加热和夹持装置已略去)。
实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检查虚线框内装置气密性的方法是____________________________。
(2)装置A的名称是________,装置B的作用是_________,装置D中所盛药品是__________。
(3)装置A中发生反应的化学方程式为____________________________。
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是__________。
(5)实验后装置A中有白色固体产生,将装置A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是______________;不可直接向装置A中加水的原因是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A.0.1 mol·L-1NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+) >c(OH-)
B.0.1 mol·L-1Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:C(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组利用如图所示装置制取氯气。提供的试剂有浓盐酸、饱和NaCl溶液、NaOH溶液、高锰酸钾固体。反应的化学方程式为![]() 。
。
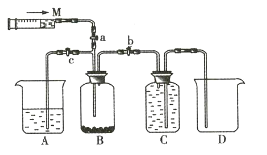
(1)浓盐酸在此反应中显示出来的性质是_______________________(填序号)。
A.还原性 B.还原性和酸性
C.氧化性 D.氧化性和酸性
(2)装置C中盛放的试剂是_______________________。
(3)尾气处理时需关闭弹簧夹a和弹簧夹___________________,打开弹簧夹_____________________。
(4)若用含1.6mol HCl的浓盐酸与足量的高锰酸钾反应,在标准状况下收集到的氯气体积_______________________(填序号)。
A. =11.2L B. >11.2L
C. <11.2L D.无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 和
和![]() 都是锂离子电池的电极材料,可利用钛铁矿
都是锂离子电池的电极材料,可利用钛铁矿![]() 主要成分为
主要成分为![]() ,还含有少量MgO、
,还含有少量MgO、![]() 等杂质
等杂质![]() 来制备,工艺流程如下:
来制备,工艺流程如下:
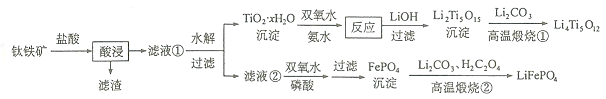
回答下列问题:
![]() “酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为
“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为![]() 时,所采用的实验条件为______。
时,所采用的实验条件为______。
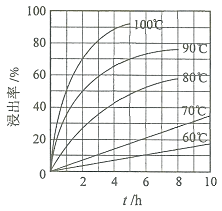
![]() “酸浸”后,钛主要以
“酸浸”后,钛主要以![]() 形式存在,写出相应反应的离子方程式______。
形式存在,写出相应反应的离子方程式______。
![]() 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度 | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | span>88 |
分析![]() 时
时![]() 转化率最高的原因______。
转化率最高的原因______。
![]() 中Ti的化合价为
中Ti的化合价为![]() ,其中过氧键的数目为______。
,其中过氧键的数目为______。
![]() 若“滤液
若“滤液![]() ”中
”中![]() ,加入双氧水和磷酸
,加入双氧水和磷酸![]() 设溶液体积增加1倍
设溶液体积增加1倍![]() ,使
,使![]() 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中![]() ,此时是否有
,此时是否有![]() 沉淀生成?______
沉淀生成?______![]() 列式计算
列式计算![]() 。
。![]() 、
、![]() 的
的![]() 分别为
分别为![]() 、
、![]()
![]() 写出“高温煅烧
写出“高温煅烧![]() ”中由
”中由![]() 制备
制备![]() 的化学方程式______。
的化学方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com