
科目: 来源: 题型:
【题目】现有下列8种与人们生产生活相关的有机物:① HCHO(防腐剂)② CH3CH2CHO(化工原料)③CH3CH2CH2CH3(打火机燃料)④ ![]() (冷冻剂)⑤
(冷冻剂)⑤ ![]() (汽车防冻液)⑥
(汽车防冻液)⑥ ![]() (杀菌剂)⑦
(杀菌剂)⑦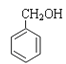 (定香剂)⑧
(定香剂)⑧ ![]() (汽油添加剂)请回答:
(汽油添加剂)请回答:
(1)属于醇的是____(填序号,下同)。
(2)互为同系物的是_____。
(3)互为同分异构体的是__。
(4)用系统命名法给④命名,其名称为_____。
(5)写出②与银氨溶液发生银镜反应的化学方程式__。
(6)写出⑧与浓硝酸反应生成TNT的化学方程式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计如图所示实验,探究反应中的能量变化,下列判断正确的是( )

A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌棒对实验结果没有影响
D.若用NaOH固体测定中和热,则测定数值偏高
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下将40g已磨成粉末的![]() 和
和![]() 置于250mL锥形瓶中,迅速搅拌使固体药品混合均匀,再在玻璃管口悬挂一块湿润的红色石蕊试纸(如图所示)。请回答下列问题:
置于250mL锥形瓶中,迅速搅拌使固体药品混合均匀,再在玻璃管口悬挂一块湿润的红色石蕊试纸(如图所示)。请回答下列问题:
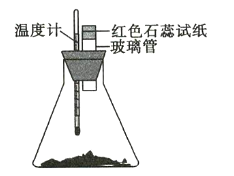
(1)湿润的红色石蕊试纸发生的变化是_________________,其原因是_______。
(2)温度计的变化是_______________________,其原因是_______________________ 。
(3)锥形瓶中发生反应的化学方程式为__________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某工业废水中仅含下表离子中的5种:
阳离子 |
|
阴离子 |
|
某同学欲探究废水的组成,进行了如下实验:
Ⅰ![]() 取废水少许加入足量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体
取废水少许加入足量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体
Ⅱ![]() 向Ⅰ中所得的溶液中加入
向Ⅰ中所得的溶液中加入![]() 溶液,有白色沉淀生成.
溶液,有白色沉淀生成.
下列推断不正确的是![]()
A.溶液中一定含有的离子是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
B.Ⅰ中加入盐酸生成无色气体的离子方程式是![]()
C.原溶液中的![]() 、
、![]() 、
、![]() 存在与否无法确定
存在与否无法确定
D.Ⅱ中产生白色沉淀的离子方程式是
查看答案和解析>>
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5:M=190 g·mol-1)在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。焦亚硫酸钠(Na2S2O5)在实验室可用如图装置制备。
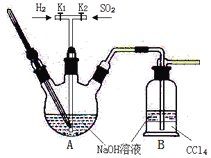
已知:2NaHSO3![]() Na2S2O5+H2O S2O52-+2H+=2SO2↑+H2O
Na2S2O5+H2O S2O52-+2H+=2SO2↑+H2O
(1)实验中如果SO2通入过多,会降低Na2S2O5的产率,试解释其原因__________。
(2)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法(杂质不与碘反应)。
已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+; 2S2O32-+I2 =S4O62-+2I-
称取0.2000 g产品放入碘量瓶中,加入40.00 mL 0.1000 mol·L-1的标准碘溶液,在暗处放置5 min,再加入适量冰醋酸及蒸馏水。用0.2000 mol·L-1的标准Na2S2O3溶液滴定剩余的碘至终点,重复操作3次,测得平均消耗标准Na2S2O3溶液20.00 mL。则产品中焦亚硫酸钠的质量分数为__________________。
(3)关于本实验的说法错误的是_________。
A.B装置中CCl4的作用是防止倒吸
B.滴定时,Na2S2O3溶液应该用碱式滴定管盛放
C.滴定终点的现象是刚好变蓝色
D.滴定时间过长会导致测得产品中焦亚硫酸钠的质量分数偏高
查看答案和解析>>
科目: 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。
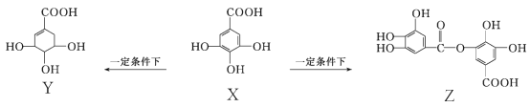
下列说法错误的是
A. 1 mol Z最多能与8 mol NaOH发生反应
B. 1 mol X与H2完全加成产物的分子式为C7H12O5
C. 向Y中滴加FeCl3溶液呈紫色
D. 1 mol Y与足量的金属钠反应放出2 mol H2
查看答案和解析>>
科目: 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。

已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题。

(1)化学反应速率本质上是由_____________ 决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明_____________ 对反应速率有影响,该因素对反应速率的具体影响是其他条件相同时,_____________反应速率越快。
(2)我们选取实验_____________(填实验序号)研究锌的形状对反应速率的影响。我们发现在其他条件相同时,反应物间的_____________反应速率越快。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少硫酸铜溶液,发现反应速率明显加快,原因是 _____________。
(4)利用表中数据,可以求出硫酸的物质的量浓度是_____________![]() (计算结果精确到小数点后一位)。
(计算结果精确到小数点后一位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子,该小组同学取100mL水样进行实验:向样品中先滴加氯化钡溶液,再滴加
中的若干种离子,该小组同学取100mL水样进行实验:向样品中先滴加氯化钡溶液,再滴加![]() 盐酸,实验过程中沉淀质量的变化如图所示.下列说法正确的是
盐酸,实验过程中沉淀质量的变化如图所示.下列说法正确的是![]()
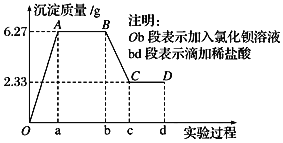
A.水样中一定不存在![]() 、
、![]() ,可能存在
,可能存在![]()
B.水样中一定存在![]() 、
、![]() 、
、![]()
C.BC段曲线所表示的离子方程式为![]()
D.水样中一定存在![]() ,且
,且![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某强酸性溶液X中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种,现取X溶液进行实验,实验过程及产物如图。下列说法正确的是
中的若干种,现取X溶液进行实验,实验过程及产物如图。下列说法正确的是![]()
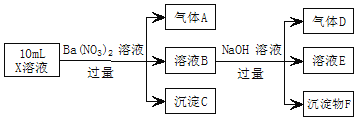
A.A是一种无色、无毒的气体
B.沉淀F为![]()
C.实验室可用排水法收集气体D
D.往溶液E中通入少量![]() ,有沉淀产生
,有沉淀产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com