
科目: 来源: 题型:
【题目】由乙烯推测丙烯(CH2=CHCH3)的结构或性质不正确的是( )
A.能使溴水褪色
B.与HCl在一定条件下加成只得到一种产物
C.最多有7个原子在同一平面上
D.在空气中燃烧时火焰明亮并伴有黑烟
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
A. υ (C)=0.5 mol / L·s B. υ(D)=0.4 mol / L·s
C. υ(B)=0.6 mol / L·s D. υ(A)=0.15 mol / L·s
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO![]() 、SO
、SO![]() 、Na+
、Na+
B.由水电离的c(H+)=1×10-14 molL-1的溶液中:Ca2+、K+、Cl-、HCO![]()
C.c(H+)/c(OH-)=1012的溶液中:NH![]() 、Al3+、NO
、Al3+、NO![]() 、Cl-
、Cl-
D.c(Fe3+)=0.1 molL-1的溶液中:K+、CO![]() 、NO
、NO![]() 、SCN-
、SCN-
查看答案和解析>>
科目: 来源: 题型:
【题目】聚碳酸酯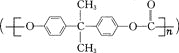 是一种高透明性的热塑性树脂,广泛用于汽车工业、仪器仪表、电器照明灯领域。它可用绿色化学原料X
是一种高透明性的热塑性树脂,广泛用于汽车工业、仪器仪表、电器照明灯领域。它可用绿色化学原料X![]() 与另一原料Y反应制得。下列说法不正确的是( )
与另一原料Y反应制得。下列说法不正确的是( )
A.该制备反应为缩聚反应
B.Y的分子式为C15H16O2
C.传统的合成方法原料X一般选用![]() ,则合成产物中必有大量HCl气体产生
,则合成产物中必有大量HCl气体产生
D.若将原料X选为CO2,在催化剂作用下实现理论原子利用率100%
查看答案和解析>>
科目: 来源: 题型:
【题目】能证明乙烯分子里含有一个碳碳双键的事实是( )
A.乙烯分子里碳氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯能使酸性KMnO4溶液褪色
D.乙烯易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质
查看答案和解析>>
科目: 来源: 题型:
【题目】H2C2O4 是二元弱酸,常温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-4下列溶液的离子浓度关系式正确的是
A.pH=2的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-2mol/L
B.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
C.将NaOH溶液滴加到H2C2O4溶液中至混合溶液呈中性:c(C2O42-)>c(HC2O4-)
D.NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁)>r(乙)>r(丙)>r(甲)。四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。据此推断,下述正确的是
A.简单氢化物的沸点:乙>丙
B.由甲、乙两元素组成的化合物溶于水呈碱性
C.丙和丁两元素的最高价氧化物的水化物之间能发生反应
D.由甲和丙两元素组成的分子,不可能含非极性键
查看答案和解析>>
科目: 来源: 题型:
【题目】醇烃化新技术是近几年合成氨工业净化精炼原料气,除去少量CO一种新方法,其原理可分为甲醇化与甲烷化两个部分。
甲醇化:![]()
![]()
甲烷化:![]()
![]()
![]() 下列措施有利于提高醇烃化过程CO转化率的是________。
下列措施有利于提高醇烃化过程CO转化率的是________。
A.及时分离出![]() 适当升高反应温度
适当升高反应温度
C.使用高效的催化剂 ![]() 适当增大压强
适当增大压强
![]() 甲醇化平衡常数可用
甲醇化平衡常数可用![]() 表示,
表示,![]() 为平衡组分中各物质的物质的量分数。若CO与
为平衡组分中各物质的物质的量分数。若CO与![]() 混合原料气中CO的体积分数为
混合原料气中CO的体积分数为![]() ,经甲醇化后CO的平衡转化率为w,则
,经甲醇化后CO的平衡转化率为w,则![]() ________
________![]() 用含w的表达式来表示
用含w的表达式来表示![]() 。
。
![]() 测试a、b两种催化剂在不同压强与温度条件下,甲醇化过程中催化效率如下图:
测试a、b两种催化剂在不同压强与温度条件下,甲醇化过程中催化效率如下图:

从上图可知选择哪种催化剂较好________![]() 填a或
填a或![]() ,理由是________。
,理由是________。
![]() 下列关于醇烃化过程说法正确的是________。
下列关于醇烃化过程说法正确的是________。
A.甲醇化与甲烷化过程在任何条件下均为自发反应
B.选择不同的催化剂可以控制醇烃化过程中生成甲醇与甲烷的百分含量
C.当温度与反应容器体积一定时,在原料气中加入少量的惰性气体,有利于提高平衡转化率与甲醇的产率
D.适当增大混合气体中![]() 的百分含量,有利于提高醇烃化过程CO平衡转化率
的百分含量,有利于提高醇烃化过程CO平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室在50~60℃下制备硝基苯的反应装置如图所示。下列有关说法错误的是( )
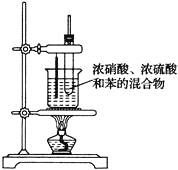
A.长玻璃导管的作用是冷凝回流、平衡压强
B.加入试剂的顺序:先加浓硝酸,再加浓硫酸,冷却后加入苯
C.将反应后的液体倒入烧杯中,加水
D.为了除去在硝基苯中的酸性物质,需要水洗、碱洗,然后再水洗
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在日常生活、生产中应用广泛。
(1)某温度下,Ksp(FeS)=8.1×10-17,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:
c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的pH约为________(填字母)。
A.2 B.3 C.4 D.5
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
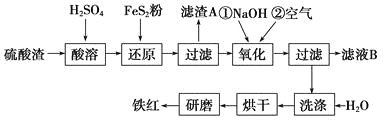
①酸溶过程中Fe2O3发生反应的离子方程式为_____________;“滤渣A”主要成分的化学式为_______________。
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式: FeS2+____Fe3++______===______Fe2++____SO42-+______
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为________________________。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8。
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
如果pH过大,可能引起的后果是____________________(几种离子沉淀的pH见上表)。
⑤滤液B可以回收的物质有________(填序号)。
A.Na2SO4 B.Al2(SO4)3 C.Na2SiO3 D.MgSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com