
科目: 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎纸条的作用是________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”或“无影响”)。
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1 NaOH溶液各50 mL进行实验,其中NaOH溶液浓度大于盐酸浓度的作用是______,当室温低于10 ℃时进行实验,对实验结果会造成较大的误差,其原因是_____________。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求得的中和热________(填“相等”或“不相等”),简述理由: ______________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,下列不能用勒夏特列原理解释的是( )
A.H2、I2、HI混合气体加压后颜色变深
B.合成氨时将氨液化分离,可提高原料的利用率
C.向氯水中缓慢加入硝酸银固体,氯水颜色变浅
D.使用MnO2作催化剂能加速H2O2的分解
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学用语的用法中,正确的是
A. BaCO3的电离方程式:BaCO3![]() Ba2++CO32—
Ba2++CO32—
B. 向沸水中滴加饱和氯化铁溶液得到红褐色液体的化学方程式:3H2O+FeCl3=3HCl+Fe(OH)3↓
C. 向酸性KI溶液中通入臭氧(O3)的离子方程式:2I—+O3+H2O==I2+O2+2OH—
D. 向Ba(OH)2溶液中滴入 NaHSO4溶液至恰好完全沉淀时,反应的离子方程式Ba2++OH—+SO42—+H+==BaSO4↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解;②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。下面是制取少量S2Cl2的装置,回答下列问题:
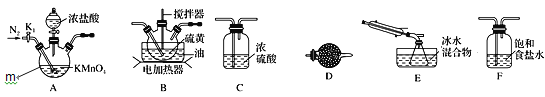
(1)仪器m的名称为______。
(2)S2Cl2的电子式为______。
(3)装置连接顺序:______→E→D。
(4)为了提高S2Cl2的纯度,实验的关键是控制好温度和________。
(5)S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状 且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式_______。
(6)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数设计了如下实验方案:
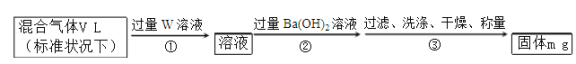
该混合气体中气体X的体积分数为_____(用含V、m的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘与氢气在一定条件下反应的热化学方程式如下:
(Ⅰ)I2(g)+H2(g)![]() 2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(Ⅱ)I2(s)+H2(g)![]() 2HI(g) ΔH=+26.48 kJ·mol-1
2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A. 在一定条件下将2 g H2(g)通入254 g I2(g)中,该过程放出的热量为9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D. 物质的量相同时,反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高
查看答案和解析>>
科目: 来源: 题型:
【题目】黄钾铁矾渣经如下流程可将其转化为锰锌铁氧体:

已知:①黄钾铁矾渣中铁主要以Fe2O3形式存在,锌主要以硫酸锌(ZnSO4)、氧化锌(ZnO)、硅酸锌(ZnSiO3)形式存在,黄钾铁矾渣的某些元素成分如下表所示:
元素 | Fe | Zn | Cu | Cd | Ca | Mg | Si |
质量分数 | 28.9 | 8.77 | 0.37 | 0.18 | 0.37 | 0.84 | 4.63 |
②NH4F溶液用于沉淀Mg2+和Ca2+,②Fe和Cd的金属活动性相近
⑴“酸浸”后,滤渣1的主要成分为________(写化学式);为了提高浸出率,可采取的措施有________(写出一种即可)。
⑵“还原除杂”工序中,加入铁粉是为了除去溶液中________、________等金属杂质离子。
⑶加入(NH4)2S沉淀Cd2+时应避免过量,原因是________;若此过程中溶液搅拌时间过长,则会导致Cd2+去除率偏低,原因是________。(已知:CdS的溶度积Ksp = 8×10-27,FeS的溶度积Ksp = 4×10-19,ZnS的溶度积Ksp = 1.6×10-24)
⑷写出“共沉淀”工序中生成FeCO3的离子反应方程式为:________。
⑸锰锌铁氧体是一种重要的磁性材料。测定铁氧体中ZnO的实验步骤如下:

①写出除锰(Mn2+)步骤中的离子方程式________。
②准确量取25.00 mL溶液A,掩蔽铁后,用二甲酚橙作指示剂,用0.0100mol/L的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+ (反应原理为Zn2+ + H2Y2- =ZnY 2- + 2H+),至滴定终点时消耗EDTA标准溶液20.00 mL。通过计算确定该铁氧体中ZnO的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:
NO(g)+CO(g)![]()
![]() N2(g)+CO2 (g) ΔH=-373.4 kJ·mol-1
N2(g)+CO2 (g) ΔH=-373.4 kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )
A.  B.
B. 
C.  D.
D. 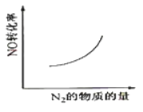
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物醇A与羧酸B发生酯化反应生成分子式为C9H18O2的酯,0.5molA完全燃烧产生的气体被足量的澄清石灰水吸收生成200g沉淀,则下列说法正确的是( )
A.A的分子式为C4H8OB.B的分子式为C5H10O2
C.酯C9H18O2在稀硫酸溶液中不水解D.有机物A、B都能与NaHCO3溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】①C(s)+O2(g)![]() CO2(g) ΔH=-393.5kJ/mol
CO2(g) ΔH=-393.5kJ/mol
②2H2(g)+O2(g)![]() 2H2O(1) ΔH=-571.6kJ/mol
2H2O(1) ΔH=-571.6kJ/mol
现在0.2mol炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93kJ的热量,则混合物中C与H2物质的量之比为
A.1︰1 B.1︰2 C.2︰3 D.3︰2
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、 E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色:反应③中有水生成,反应②需要放电才能发生,A是—种极易溶于水的气体,A和D相遇有白烟生成。
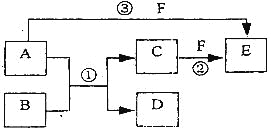
(1)反应③的化学方程式为_______________________________________________。
(2)反应①中每生成1 molC,转移的电子数为_______________________________。
(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈性___________(填“酸”“碱”或“中’’),该水溶液中存在着如下关系,用粒子浓度符号填写:
①c(H+)+_________=c(OH-)+_____________;
②c(H+)=c(OH-)+_____________。
(4)元素X与组成B的元素同周期,X的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式____________________________________;
②X、空气、海水可以组成新型海水标志灯的电池。该种灯以海水为电解质溶液,靠空气中的氧气使X不断氧化而源源不断产生电流。则该新型电池的正极的电极反应式为___________________________;原电池的总反应方程式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com