
科目: 来源: 题型:
【题目】铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿![]() 主要成分是
主要成分是![]() ,还含少量
,还含少量![]() 等杂质
等杂质![]() 制备
制备![]() ,其流程如下:
,其流程如下:

已知:![]() 水解能力:
水解能力:![]()
![]() 。
。
回答下列问题:
(1)“浸取”时,为了提高浸取速率,可采取的措施有___________![]() 任写一条
任写一条![]() ;过滤1的滤渣的主要成分有______________
;过滤1的滤渣的主要成分有______________![]() 填化学式
填化学式![]() 。
。
(2)浸取时加入过量浓盐酸的目的是____________________________________。
(3)写出焙烧时生成铋酸钠的化学方程式_________________________________。
(4)![]() 时,向浓度均为
时,向浓度均为![]() 的
的![]() 、
、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液
溶液![]() 设溶液体积增加1倍
设溶液体积增加1倍![]() ,当
,当![]() 时恰好完全沉淀,判断此时
时恰好完全沉淀,判断此时![]() 是否已经开始沉淀________
是否已经开始沉淀________![]() 填“是”或“否”
填“是”或“否”![]() 已知:
已知:![]() 、
、![]()
(5)用双硫腙![]() ,二元弱酸
,二元弱酸![]() 络合萃取法可从工业废水中提取金属离子:
络合萃取法可从工业废水中提取金属离子:![]() 先将金属离子络合成电中性的物质
先将金属离子络合成电中性的物质![]() 如
如![]() 等
等![]() ,再用
,再用![]() 萃取此络合物。下图是用上述方法处理含有
萃取此络合物。下图是用上述方法处理含有![]() 、
、![]() 、
、![]() 的废水时的酸度曲线
的废水时的酸度曲线![]() 表示金属离子以络合物形式被萃取分离的百分率
表示金属离子以络合物形式被萃取分离的百分率![]() 。
。

![]() 当调节
当调节![]() 时,铋
时,铋![]() 的存在形式为____________。
的存在形式为____________。
![]() 向萃取后的
向萃取后的![]() 中加入过量NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为____。
中加入过量NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】丙炔酸甲酯![]() 是一种重要的有机化工原料,沸点为103~105℃。实验室制备少量丙炔酸甲酯的反应为:
是一种重要的有机化工原料,沸点为103~105℃。实验室制备少量丙炔酸甲酯的反应为:![]()
![]()
![]() 。装置如下图:
。装置如下图:
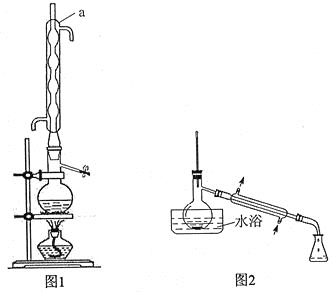
实验步骤如下:
步骤1:在反应瓶中,加入14.0g丙炔酸、50ml甲醇和2ml浓硫酸,少许碎瓷片,加热一段时间(装置见图1)。
步骤2:蒸出过量的甲醇(装置见图2)。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,称得丙炔酸甲酯12.5g。
(1)装置图中仪器a的名称是____________,其作用是__________________。
(2)蒸馏烧瓶中加入碎瓷片的目的是____________。若加热后发现未加碎瓷片,应采取的正确方法是____________________________。
(3)步骤1中,加入过量甲醇的目的除作溶剂外,还有________________。
(4)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是________________;分离出有机相的操作名称为____________。
(5)步骤4中,蒸馏时不能用水浴加热的原因是______________________________。
(6)本实验的产率是________(保留3位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
①在反应体系中加入催化剂,该反应的反应热_____(填“增大”、“减小”或“不变”)。
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率υ(N2)=___________,H2的转化率为_____________(保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是____________。
a.把气体的体积压缩至1L b.向容器中再充入惰性气体
c.改变反应的催化剂 d.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
4NH3(g)+3O2(g) ΔH=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_________0。(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸二甲酯可用作制备维生素B13的中间体,也可用作增塑剂。实验室以草酸![]() 和甲醇为原料制备草酸二甲酯的一种方法如下:
和甲醇为原料制备草酸二甲酯的一种方法如下:![]()
![]()
![]() 。
。
相关物质的有关数据如下表所示:
物质 | 苯 | 甲醇 | 草酸二甲酯 |
熔点/℃ | 5.5 | -97 | 54 |
沸点/℃ | 80.1 | 64.3 | 163.5 |
相对分子质量 | 78 | 32 | 118 |
水溶性 | 不溶 | 互溶 | 不溶 |
实验过程:向如图反应装置中加入27g草酸、40g无水甲醇、100ml苯、5ml浓硫酸,搅拌下加热回流;待反应完全后,分离出甲醇和苯,所得反应液经水洗,有机层再用10%的碳酸钠溶液洗涤,然后用蒸馏水洗涤,加无水氯化钙固体干燥;过滤,滤液冷却后析出晶体,干燥,得草酸二甲酯30.1g。
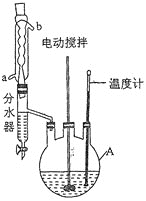
回答下列问题:
(1)仪器A的名称为____________,反应过程中冷却水应从________(填“a”或“b”)口进入。
(2)分离出甲醇和苯的操作名称为______________________________。
(3)用10%的碳酸钠溶液洗涤的目的是____________________________________。
(4)甲醇过量的目的是________________________________________________,浓硫酸的作用是_____________________________________________。
(5)分水器的优点是__________________________________________(任写一点)。
(6)本实验的产率是___________(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
A.900℃,该反应的平衡常数K<1
B.850℃达到平衡时,通入CO,CO转化率将增大
C.850℃时,若x=5.0,则起始时平衡向逆反应方向移动
D.850℃时,若要使上述反应开始时向正反应方向进行,则![]() 应满足0≤x<3
应满足0≤x<3
查看答案和解析>>
科目: 来源: 题型:
【题目】A是一种重要的化工原料,部分性质及转化关系如图:
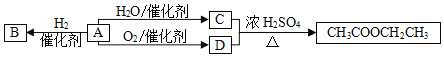
请回答:
(1)D中官能团的名称是_____。
(2)A→B的反应类型是_____。
A.取代反应B.加成反应C.氧化反应
(3)写出A→C反应的化学方程式_____。
(4)下列说法不正确的是_____。
A.B物质不能使溴水和酸性高锰酸钾褪色
B.A在一定条件下可与氯化氢发生加成反应
C.有机物C、D可用金属钠鉴别
D.A分子所有原子在同一个平面内
查看答案和解析>>
科目: 来源: 题型:
【题目】锑在工业上应用价值广泛,它的一种提取工艺流程如下:
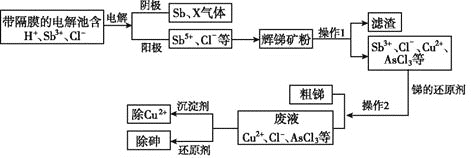
请回答下列问题:
(1)辉锑矿是含锑的重要矿物,其主要成分是![]() ,其中Sb的化合价是____。
,其中Sb的化合价是____。
(2)写出阳极区产物与辉锑矿粉主要成分发生反应的化学方程式:______________。
(3)电解池所用的“隔膜”宜采用____![]() 填“阳离子”“阴离子”或“质子”
填“阳离子”“阴离子”或“质子”![]() 交换膜。“电解”中阴极反应的产物之一X是____
交换膜。“电解”中阴极反应的产物之一X是____![]() 填化学式
填化学式![]() 。
。
(4)为除去操作1所得滤液中的![]() ,可加入
,可加入![]() 。若滤液中
。若滤液中![]() ,当溶液中
,当溶液中![]() 完全沉淀时,
完全沉淀时,![]() ____
____![]() 。
。 ![]() 已知
已知![]()
(5)除去废液中的![]() ,是用次磷酸钠
,是用次磷酸钠![]() 还原
还原![]() ,产生了棕色单质砷沉淀和
,产生了棕色单质砷沉淀和![]() 。该反应中氧化剂和还原剂的物质的量之比为____。
。该反应中氧化剂和还原剂的物质的量之比为____。
(6)若电解池阴极得到![]() 气体,同时电路中转移
气体,同时电路中转移![]() ,阴极生成的
,阴极生成的![]() ___g。
___g。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分为![]() )提取氧化铝作冶炼铝的原料,提取的操作过程如下:
)提取氧化铝作冶炼铝的原料,提取的操作过程如下:

(1)反应1结束后的操作名称为_______。
(2)滤渣的主要成分是___________________。
(3)反应2中通入的过量气体为________
a. 二氧化碳 b.氨气 c.氮气
(4)写出B煅烧生成Al2O3的化学反应方程式:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g)△H=-197kJ/mol。实验测得起始、平衡时的有关数据如下表:
2SO3(g)△H=-197kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是
A.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1>-197 kJ·mol-1
B.Q1=Q2=Q3=197kJ
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最小
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积均为1.0 L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A.化学平衡常数K:K(状态I)<K(状态II)<K(状态III)
B.CO2的平衡转化率α:α(状态I)<α(状态Ⅱ)=α(状态III)
C.体系中c(CO):c (CO,状态Ⅱ)<2c (CO,状态Ⅲ)
D.逆反应速率υ逆:υ逆(状态Ⅰ)>υ逆(状态Ⅲ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com