
科目: 来源: 题型:
【题目】丙烯酸是合成丙烯酸脂的原料,丙烯醇用于生产甘油、塑料等。某小组以丙烯醛为原料生产丙烯醇、丙烯酸的流程如图所示:
 已知反应原理:
已知反应原理:![]()
![]()
有关物质的物理性质如表:
| 丙烯醛 | 丙烯醇 | 丙烯酸 | 四氯化碳 |
沸点/℃ | 53 | 97 | 141 | 77 |
熔点/℃ | -87 | -129 | 13 | -22.8 |
密度/gcm-3 | 0.84 | 0.85 | 1.02 | 1.58 |
溶解性(常温) | 易溶于水和 有机物 | 溶于水和 有机溶剂 | 溶于水和 有机溶剂 | 难溶于水, 易溶于有机物 |
(1)已知苯的沸点为80.1℃,上述步骤②的萃取剂用四氯化碳而不用苯,其主要原因可能是_________________。上层液体分液漏斗________(填“上”或“下”)口倒(或放)出。
(2)从步骤④的残留液中可提取一种无水正盐,它是________(填化学式)。
(3)步骤⑤采用如图装置,该装置有一处明显错误,请指出错误:________,并改之。收集丙烯醇的温度应控制在________左右。

(4)已知:醛类具有较强还原性,能与溴水、酸性高锰酸钾溶液、银氨溶液等反应。某同学为了证明丙烯酸产品中含有丙烯醛,设计如下方案:
a.取少量溴水于试管,加入适量丙烯酸样品,振荡,溶液褪色
b.取少量酸性高锰酸钾溶液于试管,加入适量丙烯酸样品,振荡,溶液褪色
c.取少量银氨溶液于试管,加入适量丙烯酸样品,用水浴加热,有银镜产生
d.取少量酸性重铬酸钾溶液于试管,加入适量丙烯酸样品,振荡,溶液由橙红色变成绿色
上述方案中,能证明丙烯酸产品中含少量丙烯醛的是________(填字母)。
(6)为了证明丙烯酸是弱酸,设计如下方案,其中能达到实验目的的是________(填字母)。
代号 | 方案 | 预测现象 |
A | 取少量 | 溶液变红色 |
B | 常温下,将10ml0.1molL-1NaOH溶液和10ml0.1molL-1 | pH>7 |
C | 用相同的导电仪分别测定盐酸溶液、 | 前者灯泡较亮 |
查看答案和解析>>
科目: 来源: 题型:
【题目】中草药秦皮中含有的七叶树内酯(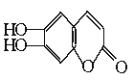 碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
A. 3mol Br22mol NaOH B. 3mol Br24mol NaOH
C. 2mol Br23mol NaOH D. 4mol Br24mol NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 准确量取25.00mL的液体可选用移液管、量筒或滴定管等量具
B. 实验过程中若皮肤不慎沾上少量酸液,应先用大量水冲洗,再用饱和碳酸氢钠溶液洗,最后再用水冲洗
C. 用分液漏斗分液时要经过振荡、放气、静置后,从上口倒出上层液体,再打开旋塞,将下层液体从下口放出
D. 在中和热测定实验中,盐酸和NaOH溶液的总质量mg,反应前后体系温度变化为t,反应液的比热容为![]() ,则生成1mol水放出的热量为
,则生成1mol水放出的热量为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某探究小组的同学用50mL ![]() 溶液与
溶液与![]() KOH溶液按图示装置进行中和反应,并根据反应放出的热量计算反应热。下列说法中错误的是
KOH溶液按图示装置进行中和反应,并根据反应放出的热量计算反应热。下列说法中错误的是
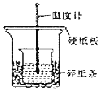
A.两烧杯口应在同一高度,烧杯间应填满碎纸条以减少热量损失
B.为使酸和碱充分混合,图中实验装置应加上环形玻璃搅拌棒和碎纸条
C.实验时![]() 溶液与KOH溶液需一次性混合,还需测量混合液温度的最高值
溶液与KOH溶液需一次性混合,还需测量混合液温度的最高值
D.若换成![]() 溶液与该KOH溶液反应,放出的热量相等
溶液与该KOH溶液反应,放出的热量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验室废液含![]() 、Na+、Fe3+、Cr3+、
、Na+、Fe3+、Cr3+、![]() 、
、![]() 等离子,现通过如下流程变废为宝制备K2Cr2O7。
等离子,现通过如下流程变废为宝制备K2Cr2O7。
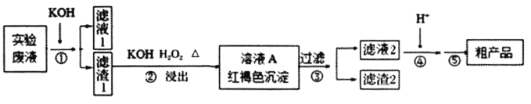
已知:
(a)![]() ;
;![]()
(b)金属离子形成氢氧化物沉淀的pH范围如表。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 2.7 | 3.7 |
Cr3+ | 4.9 | 6.8 |
请回答:
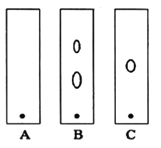
(1)某同学采用纸层析法判断步骤①加入KOH的量是否合适。在加入一定量KOH溶液后,用毛细管取样、点样、薄层色谱展开、氨熏后的斑点如图所示。加入KOH最适合的实验编号是(实验顺序已打乱)________,C的斑点颜色为________。
(2)步骤②含Cr物质发生的主要反应的离子方程式为________________________。
(3)在下列装置中,②应选用________。(填标号)
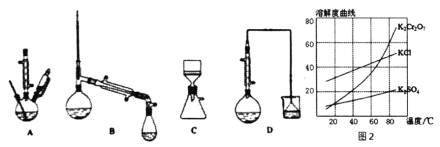
(4)部分物质的溶解度曲线如图2,步骤⑤可能用到下列部分操作:a.蒸发至出现大量晶体,停止加热;b.冷却至室温;c,蒸发至溶液出现晶膜,停止加热;d.洗涤;e.趁热过滤;f.抽滤。请选择合适操作的正确顺序________。
(5)步骤⑤中合适的洗涤剂是________(“无水乙醇”、“乙醇-水混合液”、“热水”、“冰水”)。
(6)取mg粗产品配成250mL溶液,取25.00mL于锥形瓶中,用cmol·L-1的(NH4)2Fe(SO4)2标准溶液滴定(杂质不反应),消耗标准(NH4)2Fe(SO4)2溶液VmL,则该粗产品中K2Cr2O7的纯度为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,表中字母分别表示一种元素。请回答下列问题:
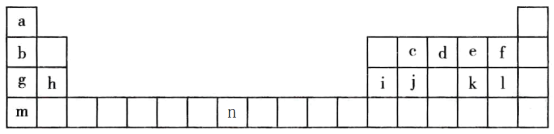
(1)a的三种核素分别为______、______、______。(用汉字表示)
(2)j是一种良好的____________材料,写出元素j的氧化物的一种用途____________。
(3)a、d、f、g四种元素的原子半径由小到大的顺序为________(用元素名称表示)。
(4)c、d、j、l四种元素最高价氧化物对应的水化物的酸性由强到弱的顺序为______(用化学式表示)。
(5)上述元素形成的氢化物中最稳定的是_____,溶于水显碱性的是_____。
(6)e、k 两种元素得电子能力强的是_____ (用元素符号表示)
(7)元素g、e 形成的原子个数1:1的化合物的化学式为_____,阴阳离子个数比为为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。

依据上述转化关系,回答下列问题:
(1)丙烯分子中,最多有________个原子在同一个平面上。
(2)聚合物F的结构简式是________________________。
(3)写出B→C的化学方程式:__________________________________________。
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
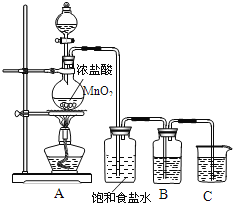
(1)盛装MnO2的仪器名称:_____
(2)实验室制氯气的反应原理为:__HCl(浓)+__MnO2 =加热=__MnCl2+__Cl2↑+__H2O(请将方程式中反应系数补充完整)
(3)盛有饱和食盐水的洗气瓶的作用是______.
(4)装置B中盛放的试剂是______(填选项),实验现象为______.
a.Na2S溶液b.Na2SO3溶液c.Na2SO4溶液
(5)装置C中盛放烧碱稀溶液,目的是______.
(6)能证明氯元素比硫元素非金属性强的依据为______.(填序号)
①氯原子比硫原子更容易获得电子形成离子;
②次氯酸的氧化性比稀硫酸强;
③S2-比Cl-还原性强;
④HCl比H2S稳定.
查看答案和解析>>
科目: 来源: 题型:
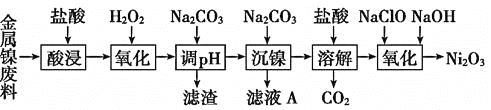
【题目】三氧化二镍![]() 是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料
是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料![]() 含有少量的铁、铝等杂质
含有少量的铁、铝等杂质![]() ,继而生产
,继而生产![]() 的工艺流程如下:
的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的![]() 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为![]() 计算
计算![]() 。
。
氢氧化物 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有______
A. 降低温度 ![]() 搅拌
搅拌 ![]() 减少盐酸的浓度
减少盐酸的浓度 ![]() 将废料研成粉末
将废料研成粉末
(2)酸浸后的酸性溶液中加入![]() 的目的:__________。沉镍前需加
的目的:__________。沉镍前需加![]() 控制溶液pH范围为______,所得到滤渣的主要成分是_______。
控制溶液pH范围为______,所得到滤渣的主要成分是_______。
(3)从滤液A中可回收利用的主要物质是![]() 和________。
和________。
(4)“氧化”生成![]() 的离子方程式为__________________________。
的离子方程式为__________________________。
(5)工业上用镍为阳极,电解![]() 溶液与一定量
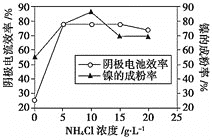
溶液与一定量![]() 组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,
组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,![]() 的浓度对阴极电流效率及镍的成粉率的影响如图所示,则
的浓度对阴极电流效率及镍的成粉率的影响如图所示,则![]() 的浓度最好控制为_________。
的浓度最好控制为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯。苯甲酸乙酯(密度1.05gcm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等。制备苯甲酸乙酯的过程如下:
I.制备粗产品:如图所示装置中,于50ml圆底烧瓶中加入8.0g苯甲酸(Mr=122)、20ml乙醇(Mr=46,密度0.79gcm-3)、15ml环己烷、3ml浓硫酸,摇匀,加沸石。在分水器中加水,接通冷凝水,水浴回流约2h,反应基本完成。记录体积,继续蒸出多余环己烷和醇(从分水器中放出)。
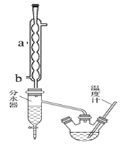
粗产品纯化:加水30ml,分批加入固体NaHCO3,分液,然后水层用20ml石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210~213℃馏分。
相关数据如下:
沸点(℃,1atm) | ||||||
苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物 |
249 | 212.6 | 40~80 | 100 | 78.3 | 80.75 | 62.6 |
根据以上信息和装置图回答下述实验室制备有关问题:
(1)写出制备苯甲酸乙酯反应的化学方程式_____________________________________,
仪器a的名称______________,冷凝水的进水口为______(填a或b)。
(2)在本实验中可以提高苯甲酸乙酯产率的方法有:_________________________________。
A.加入环已烷形成水![]() 乙醇
乙醇![]() 环已烷三元共沸物分离出反应过程中生成的水
环已烷三元共沸物分离出反应过程中生成的水
B.加过量的乙醇
C.使用分水器及时分离出生成的水
(3)如何利用实验现象判断反应已基本完成_____________________________________。
(4)固体NaHCO3的作用______________________________,加入固体NaHCO3后实验操作分液所用到的主要玻璃仪器为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com