
科目: 来源: 题型:
【题目】科学家设计了一种可以循环利用人体呼出的CO2并提供O2的装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )
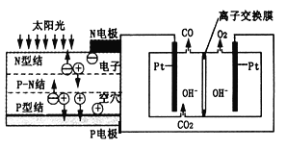
A. 由图分析N电极为电池的正极
B. 阴极的电极反应为CO2+H2O+2e-=CO+2OH-
C. OH-通过离子交换膜迁向左室
D. 反应完毕,该装置中电解质溶液的碱性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组拟以对苯二酚为原料合成染料G。合成路线如下:
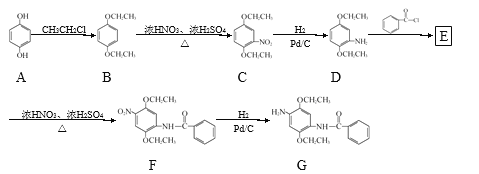
![]()
![]() 中的含氧官能团名称为________、________。
中的含氧官能团名称为________、________。
![]() 的反应类型为________。
的反应类型为________。
![]() 的分子式为
的分子式为![]() ,写出E的结构简式:________。
,写出E的结构简式:________。
![]() 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___。
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___。
![]() 含有苯环,且分子中有一个手性碳原子,能与
含有苯环,且分子中有一个手性碳原子,能与![]() 溶液发生显色反应;
溶液发生显色反应;![]() 能发生水解反应,水解产物均有4种不同环境的氢且水解产物之一是
能发生水解反应,水解产物均有4种不同环境的氢且水解产物之一是![]() 氨基酸。
氨基酸。
![]() 已知:
已知:![]() 苯胺
苯胺![]()
![]()
![]() 易被氧化;
易被氧化;![]()
![]()
![]()
![]()
![]() ,写出以
,写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图________(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图________(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目: 来源: 题型:
【题目】可用来鉴别己烯、甲苯(![]() )、乙酸乙酯、乙醇的一组试剂是(已知:甲苯密度比水小,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液紫色褪去( )
)、乙酸乙酯、乙醇的一组试剂是(已知:甲苯密度比水小,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液紫色褪去( )
A.溴水、氯化铁溶液B.溴水、酸性高锰酸钾溶液
C.溴水、碳酸钠溶液D.氯化铁溶液、酸性高锰酸钾溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】火电厂粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。某研究小组对其进行综合处理的流程如图所示:
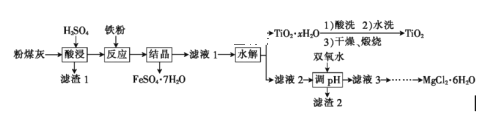
已知:①“酸浸”后钛主要以TiOSO4的形式存在,强电解质TiOSO4在溶液中仅能电离出SO42-和TiO2+,TiO2+在80℃左右水解生成TiO2·xH2O。
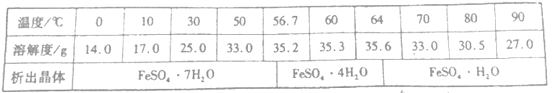
②已知FeSO4在不同温度下的溶解度和析出晶体的组成如下表:
回答下列问题:
(1)加快“酸浸”速率的措施有哪些?写出一条即可___,滤渣1的主要成分为___(填化学式)。
(2)“反应”时加入铁粉的作用为___(用离子方程式表示)。
(3)“结晶”时,若要获得FeSO4·7H2O,则对溶液进行的操作是:蒸发浓缩,___,过滤,洗涤,干燥。
(4)“水解”反应的离子方程式为____。
(5)实验室用MgCl2·6H2O制备MgCl2固体,在加热的同时要不断通入___(填化学式,下同)若不通入该物质,最终得到的产物中可能含有___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列推断正确的是( )
A.BF3是三角锥形分子
B.NH4+的电子式: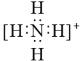 ,离子呈平面形结构
,离子呈平面形结构
C.CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键
D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H σ键
查看答案和解析>>
科目: 来源: 题型:
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理后的排放情况。
I、实验室通过如图所用的装置制备Na2S2O3
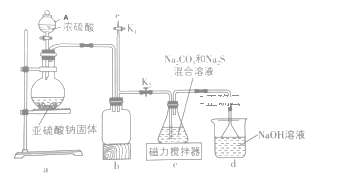
(1)仪器A的名称___,使用前注意的事项___。
(2)b装置的作用是___。
(3)装置a中发生反应的化学方程式____。
(4)反应开始后,c中先有淡黄色浑浊产生,此浑浊物为___(填化学式);反应后剩余的SO2全部被d中的氢氧化钠溶液吸收,若恰好生成酸式盐,反应后的溶液呈___(“酸”或“碱”)性,原因是___。
II、已知:废水中氰化钠的最高排放标准为0.50mg/L。
(1)向氰化钠溶液中通入少量CO2能发生反应:NaCN+CO2+H2O=HCN+NaHCO3,浓度相同①NaCN、②Na2CO3、③NaHCO3三种溶液pH值由大到小的顺序(用序号表示):___。
(2)工业上常用碱性氯化法处理含氰废水,其原理如下:第一步,NaCN与NaClO反应,生成NaOCN和NaCl;第二步,NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。某工厂含氰废水中NaCN的含量为1.47mg/L,处理10m3这样的废水,理论上需要5mol/LNaClO溶液___L处理后才可以进行排放。
查看答案和解析>>
科目: 来源: 题型:
【题目】I、烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下检测方法。回答下列问题:
将vL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化成NO3-,加水稀释至100.00mL。量取20.00mL该溶液,加入v1mLc1mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2mL。
(1)NO被H2O2氧化为NO3-的离子方程式为___。
(2)加水稀释到100.00ml所用的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要___;滴定操作使用的玻璃仪器主要有____。
(3)滴定过程中发生下列反应:
3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则气样中NOx折合成NO2的含量为___mg/L。
(4)下列操作会使滴定结果偏高的是____
A.滴定管未用标准液润洗
B.锥形瓶洗净后还存留少量的水
C.滴定管滴定前读数正确,滴定后俯视读数
D.FeSO4标准溶液部分变质
II、常温下,用酚酞作指示剂,用0.10mol·L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的 CH3COOH溶液和HCN溶液所得滴定曲线如图。
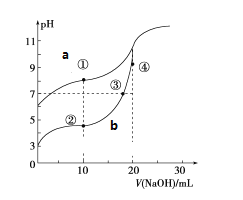
(已知:CH3COOH、 HCN的电离平衡常数分别为1.75×10-5、6.4×10-10)
(1)图___(a或b)是NaOH溶液滴定HCN溶液的pH变化的曲线,判断的理由是___。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:____。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)___c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)点②③④所示的溶液中水的电离程度由大到小的顺序是:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,向20ml0.1mol/L某酸HA溶液中逐滴加入0.1mol/LNaOH溶液,混合溶液的pH变化曲线如图所示。下列说法错误的是( )。
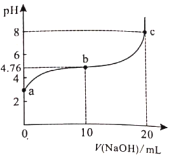
A.HA是弱酸B.b点溶液中:![]()
C.b、c之间一定存在![]() 的点D.a、b、c三点中,c点水的电离程度最大
的点D.a、b、c三点中,c点水的电离程度最大
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年5月千年繁华的古城扬州开通了宁启动车,标志着古城扬州正式迈入“动车时代”,动车铁路在建设施工中要大量使用各种材料.
①生产水泥和玻璃都用到的原料是______;制备玻璃的反应方程式______![]() 任写一个
任写一个![]() .
.
②动车车厢内饰板材多采用![]() 聚碳酸酯
聚碳酸酯![]() 及PC合金板材,PC属于______
及PC合金板材,PC属于______![]() 填字母
填字母![]() .
.
![]() 金属材料
金属材料![]() 无机非金属材料
无机非金属材料![]() 有机高分子材料
有机高分子材料
③动车大量使用铝合金材料制作车厢.下列有关铝合金叙述正确的是______![]() 填字母
填字母![]() .
.
![]() 属于纯净物
属于纯净物![]() 密度小,硬度大
密度小,硬度大![]() 在空气中易被腐蚀
在空气中易被腐蚀
④铁路建设中如何防止铁轨的腐蚀是工程技术人员攻克的难题之一.铁在发生电化学腐蚀时的负极反应方程式为______.
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A是常用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G均为有机物,他们之间有如图转化关系,请回答下列问题:

(1)写出A中官能团的名称:A________ , B中官能团的电子式B________ 。
(2)在F的同系物中最简单的有机物的空间构型为________ 。
(3)写出与F互为同系物的含5个碳原子的所有同分异构体中一氯代物种类最少的物质的结构简式:___________________________________________ 。
(4)写出下列编号对应反应的化学方程式,并注明反应类型:
④_____________________________ ,________反应 ;
⑦_____________________________ ,________反应 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com