
科目: 来源: 题型:
【题目】硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是_______。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有_______。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
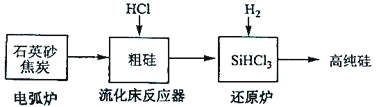
发生的主要反应 | |
电弧炉 | SiO2+2C |
流化床反应器 | Si+3HCl |
还原炉 | SiHCl3+H2 |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为_______;碳化硅又称_______,其晶体结构与_______相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的产物为_______。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。

已知:①Fe3+ Cu2+ 开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为 Kg。
(2)氧化步骤中发生的离子反应方程式为①
②AsO2— + H2O2+ H+=H3AsO4 ③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I为
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组探究石蜡油裂解产物,设计如图实验。下列说法正确的是
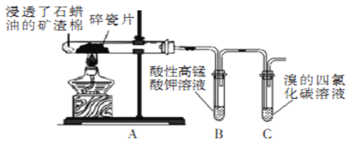
A.实验完毕后先熄灭酒精灯后拆导管
B.两支试管中发生的反应类型相同
C.可观察到B和C试管中液体褪色和分层
D.本实验能证明其产物含有碳碳不饱和键
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸亚铁![]() 为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产
为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产![]() 的原料,实验室利用
的原料,实验室利用![]() 、
、![]() 及
及![]() 为原料制备磷酸亚铁的实验流程如图1:
为原料制备磷酸亚铁的实验流程如图1:
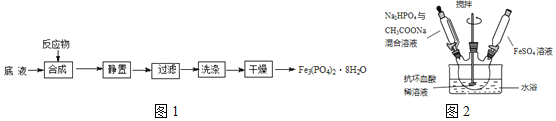
合成时的主要反应为:![]()
![]() 实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是______。
实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是______。
![]() 合成时,在三口烧瓶中先加入抗坏血酸
合成时,在三口烧瓶中先加入抗坏血酸![]() 稀溶液作底液,再向烧瓶中,滴入
稀溶液作底液,再向烧瓶中,滴入![]() 与
与![]() 混合溶液至
混合溶液至![]() 时,再滴入
时,再滴入![]() 溶液,最终维持
溶液,最终维持![]() 装置如图2所示
装置如图2所示![]() 。
。
![]() 实验不是将三种溶液直接混合的原因是______。
实验不是将三种溶液直接混合的原因是______。
![]() 用抗坏血酸溶液作底液而不用铁粉,其主要原因是______。
用抗坏血酸溶液作底液而不用铁粉,其主要原因是______。
![]() 生成的
生成的![]() 沉淀需充分洗涤,检验洗涤是否完全的方法是______
沉淀需充分洗涤,检验洗涤是否完全的方法是______
![]() 检验产品中是否混有
检验产品中是否混有![]() 或
或![]() 杂质的方法是______。
杂质的方法是______。
![]() 某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠
某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠![]() 含
含![]() 、重金属盐及有色杂质等
、重金属盐及有色杂质等![]() 提纯得到
提纯得到![]() 晶体。已知:
晶体。已知:![]() 溶液pH
溶液pH![]() ,重金属硫化物不溶于水。
,重金属硫化物不溶于水。
请补充实验步骤
![]() 实验中必须使用的试剂有:
实验中必须使用的试剂有:![]() 溶液、活性炭、
溶液、活性炭、![]() 溶液、乙醇
溶液、乙醇![]() 磷酸氢二钠在水中溶解度
磷酸氢二钠在水中溶解度![]() 水
水![]()
温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|
|
|
|
| |||||||
|
| ||||||||||
|
|
|
|
|
| ||||||
|
|
将工业品溶于适量热水,______。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是

A. 甲、乙的化学式均为C8H14
B. 乙的二氯代物共有7种(不考虑立体异构)
C. 丙的名称为乙苯,其分子中所有碳原子可能共平面
D. 甲、乙、丙均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】两种盐的稀溶液:amol·L-1NaX溶液和bmol·L-1NaY溶液。下列说法不正确的是( )
A.若a=b,且pH(NaX)>pH(NaY),则酸性HX<HY
B.若a>b,且c(X-)=c(Y-),则溶液中c(HX)>c(HY)
C.若a=b,且c(X-)=c(Y-)+c(HY),则HX为强酸
D.若两溶液等体积混合后c(X-)+c(HX)=c(Y-)+c(HY)=0.1mol·L-1,则a=b=0.1mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L。下列各组混合烃中不符合此条件的是( )
A.CH4 C2H4B.CH4 C3H6
C.C2H4 C3H4D.C2H4 CH4
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)请用下列10种物质的序号填空:①O2②H2③NH4NO3④K2O2⑤Ba(OH)2⑥CH4⑦CO2⑧NaF ⑨NH3⑩I2
既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:______________;若XY2为共价化合物时,其结构式为:__________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103Pa),但在180℃就开始升华,据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是____________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:

①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的是______;
A.c和f | B.b和g | C.d和g | D.b和e |
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g) ΔH>0。该反应在恒容密闭容器中达到平衡后,若仅改变图中横轴x的值,纵轴y随x变化趋势合理的是( )
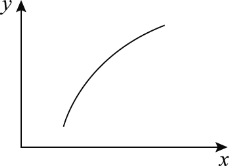
选项 | x | y |
A | CO的物质的量 | CO2与CO的物质的量之比 |
B | 反应温度 | 逆反应速率 |
C | 体系压强 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注。一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)![]() CaS(s)+3CO2(g) △H=-394.0kJ/mol。保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):
CaS(s)+3CO2(g) △H=-394.0kJ/mol。保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):
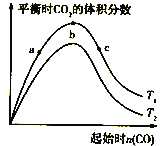
下列有关说法正确的是
A. T1比T2高 B. b点SO2转化率最高
C. b点后曲线下降是因CO体积分数升高 D. 减小压强可提高CO、SO2转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com