
科目: 来源: 题型:
【题目】对氮及其化合物的研究具有重要意义。
(1)对于2NO(g)+O2(g) ![]() 2NO2(g)反应包含以下两个基元反应:
2NO2(g)反应包含以下两个基元反应:
① 2NO(g) ![]() N2O2(g)(快) ΔH1<0 ,υ1正=k1正c2(NO)、υ1逆=k1逆c(N2O2);
N2O2(g)(快) ΔH1<0 ,υ1正=k1正c2(NO)、υ1逆=k1逆c(N2O2);
② N2O2(g)+O2(g) ![]() 2NO2(g)(慢) ΔH2<0,υ2正=k2正c(N2O2)c(O2)、υ2逆=k2逆c2(NO2);决定2NO(g)+O2(g)
2NO2(g)(慢) ΔH2<0,υ2正=k2正c(N2O2)c(O2)、υ2逆=k2逆c2(NO2);决定2NO(g)+O2(g) ![]() 2NO2(g)反应速率快慢的基元反应是________(填标号)。一定条件下,反应2NO(g)+O2(g)
2NO2(g)反应速率快慢的基元反应是________(填标号)。一定条件下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,平衡常数K=_______(用含有k1正、k1逆、k2正、k2逆 的代数式表示)
2NO2(g)达到平衡状态,平衡常数K=_______(用含有k1正、k1逆、k2正、k2逆 的代数式表示)
(2)使用SNCR脱硝技术的主反应为:
4NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2O(g) △H<0
4N2(g)+6H2O(g) △H<0
副反应:4NH3(g)+4O2 (g) ![]() 2N2O (g)+6H2O (g) △H<0
2N2O (g)+6H2O (g) △H<0
下表在密闭体系中进行实验,起始投入一定量NH3、NO、O2,测定不同温度下,在相同时间内各组分的浓度。
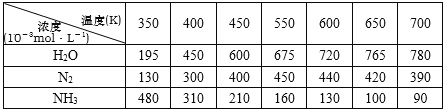
N2浓度变化趋势___________________,试解释原因______________________,
根据表中数据推测,副反应开始发生的温度区间是_____________________。
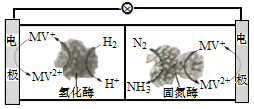
(3)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。请写出氮气在固氮酶作用下发生的化学反应_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸盐是优良的多功能水处理剂。某实验小组釆用如图装置制备高铁酸钾(K2FeO4)并探究其性质用途。

Ⅰ.制备K2FeO4(夹持、加热等装置略)

(1)B中所用试剂为______________________。
(2)C中反应为放热反应,而反应温度须控制在0~8℃,可使用的控温方法为___________,充分反应后得到紫色固体,反应方程式为___________。反应中KOH必须过量的原因是___________。
(3)C中混合物经过滤、洗涤、干燥,得纯浄髙铁酸钾晶体,洗涤时洗涤剂可选用___________。
a.冰水 b.KOH溶液 c.异丙醇
Ⅱ.探究K2FeO4的性质
(4)K2FeO4可以将废水中的CN-氧化为CNO-,实验表明,pH=9时CN-去除效果最佳。配平反应离子方程式:____FeO42-+____CN-+____H2O→____Fe(OH)3↓+____CNO-+___OH-。
现处理含CN-离子浓度为13mg/L的废水1m3,至少需要K2FeO4___________g。
(5)资料表明,酸性溶液中氧化性FeO42->MnO4-。验证实验:将少K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有MnO4-___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验测得常温下0.1mol/L某一元酸HA溶液的pH值大于1,0.1mol/L某一元碱BOH溶液里![]() =10-12。将此两种溶液等体积混合后,所得溶液的各离子的浓度由大到小排列的顺序( )
=10-12。将此两种溶液等体积混合后,所得溶液的各离子的浓度由大到小排列的顺序( )
A.c(B+)>c(A-)>c(OH-)>c(H+)B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)=c(A-)>c(H+)=c(OH-)D.c(B+)>c(A-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】(I)小明同学想通过比较两种最高价氧化物水化物的酸性强弱来验证S与C的非金属性的强弱,他查阅了资料:可以利用强酸制备弱酸的原理来判断酸性强弱。于是小明采用了下图所示的装置进行实验。请回答:
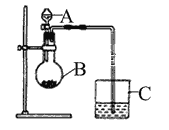
(1)仪器A的名称是________,应盛放下列药品中的__________。
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是________,应盛放下列药品中的__________。
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了_____________,即可说明H2SO4 比H2CO3 酸性强,非金属性S比C强,B中发生反应的离子方程式为______________________________。
(II)(1)用电子式表示下列化合物的形成过程:
CaF2:_____________________________________________
H2S:______________________________________________
(2)有下列物质:①NaOH ②I2 ③MgCl2 ④Na2O2 ⑤氩气 回答下列问题:
①不存在化学键的是_________________________,
②既存在离子键又存在极性键的是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)蓄电池是一种反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应如下:NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
①此蓄电池在充电时,电池负极应与外加电源的___极连接,电极反应式为__________。
②放电时生成Ni(OH)2的一极,在充电时发生_______反应(填“氧化”或“还原”)
(2)按如图所示装置进行下列不同的操作
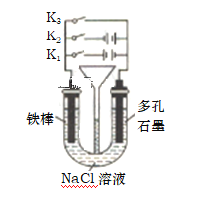
①将K1 、K2、 K3分别只关闭一个,则铁的腐蚀的速度最快的是只闭合_____(填“K1”或 “K2”或“K3”,下同),为减缓铁的腐蚀, 只闭合_____,该防护法称为__________________________。
②只闭合K3,当铁棒质量减少5.6g时,石墨电极消耗的气体体积为__________L(标准状况)。
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期主族元素 X、Y、Z、W 的相对位置如表,元素 X 的原子核外电子数是 Z的 2 倍。下列说法不正确的是
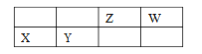
A. W 元素的简单气态氢化物的热稳定性比 Z 元素的简 单气态氢化物的高
B. 气体分子(ZW)2 的结构式为 N≡C—C≡N
C. X、Y、W 三种元素的简单离子半径最大的是 Y
D. 元素 X 位于周期表中第三周期、第ⅡA族,其单质制备可用电解熔融 XCl2 的方法。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种重要的可再生能源。
Ⅰ.已知:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-70.8 kJ·mol-1 CO(g)+2H2(g)=CH3OH(g) △H=-90.5 kJ·mol-1
写出由CH4和O2制取CH3OH(g)的热化学方程式_____________________。
Ⅱ.对于反应CO(g)+2H2(g)=CH3OH(g),回答下列问题:
(1)图1是CO(g)和CH3OH(g)物质的量浓度随时间(t)的变化曲线,从反应开始至达到平衡时,用H2表示的反应速率υ(H2)=________,CO的转化率为_________。
(2) 在容积为2L的刚性容器中充入5mol CO和10mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)的变化曲线如图2所示。
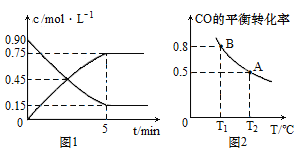
①计算B点平衡常数KB=______;达到平衡时,若再充入2mol CO、4mol H2和2mol CH3OH,反应向__________进行(填“正反应方向”或“逆反应方向”)。
②比较KA、KB的大小________。
③能判断该反应达到化学平衡状态的是____(填字母序号)。
A.H2的体积分数不再改变
B.H2的消耗速率等于CH3OH的生成速率的2倍
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
查看答案和解析>>
科目: 来源: 题型:
【题目】在某温度下的水溶液中,c(H+)=10xmol·L﹣1 ,c(OH﹣)=10ymol·L﹣1。x与y的关系如图所示:(已知lg2=0.3)
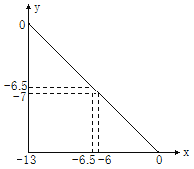
(1)水的离子积为___________________。
(2)0.01mol·L-1 H2SO4溶液的pH=________。
(3)pH=7的溶液呈________ (填“酸性”、“中性”或“碱性”)。
(4) 若测得某溶液中,水电离出来的c(OH-)=1.0×10-12 mol·L-1,且溶液为强碱溶液,则该溶液的pH=______。中和100 mL该溶液需消耗HCl的物质的量为______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.此酸的电离平衡常数约为1×10-7
B.升高温度,溶液的pH增大
C.该溶液的pH=4
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目: 来源: 题型:
【题目】已知图一表示的是可逆反应CO(g)+H2(g)![]() C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)![]() N2O4(g) ΔH<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是( )
N2O4(g) ΔH<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是( )

A. 若图一t2时改变的条件是增大压强,则反应的ΔH增大
B. 图一t2时改变的条件可能是升高了温度或增大了压强
C. 图二t1时改变的条件可能是升高了温度或增大了压强
D. 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com