
科目: 来源: 题型:
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
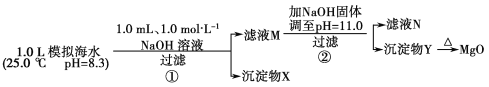
模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。Ksp[CaCO3]=4.96×10-9,Ksp[MgCO3]=6.82×10-6,Ksp[Ca(OH)2]=4.68×10-6,Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某样品中所含晶体FeSO47H2O的质量分数,取晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.2000molL-1KMnO4溶液20.00mL,所得晶体中FeSO47H2O的质量分数为__(用a表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(Ⅵ)是主要污染物,可采用多种处理方法将其除去。查阅资料可知:
①在酸性环境下,Cr(Ⅵ)通常以Cr2O72-的形式存在;
②Cr2O72-的氧化能力强于CrO42-;
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的pH | 1.9 | 7.0 | 4.3 |
沉淀完全的pH | 3.2 | 9.0 | 5.6 |
Ⅰ.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(Ⅵ)。下列关于焦炭的说法正确的是_______(填字母代号)。
a.作原电池的正极 b.在反应中作还原剂 c.表面可能有气泡产生
Ⅱ.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。电解装置如图1所示。
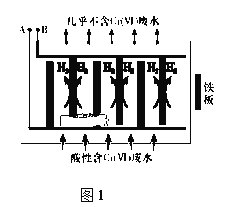
(2)A极连接电源的______________极,A极上发生的电极反应式为_______________
(3)电解开始时,B极上除了发生产生H2的反应外,还有少量Cr2O72-在B极上直接放电,该反应的电极反应式为_________________
(4)电解过程中,溶液的pH不同时,通电时间(t)与溶液中铬元素去除率的关系如图2所示。
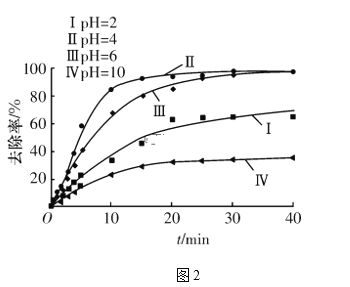
①由图可知,电解还原法应采取的最佳pH范围为____(填字母代号)。
a.2~4 b.4~6 c.6~10
②解释曲线Ⅰ和曲线Ⅳ去除率低的原因:________________
查看答案和解析>>
科目: 来源: 题型:
【题目】镁﹣次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣下列有关说法正确的是( )

A. 电池工作时,C溶液中的溶质是MgCl2
B. 电池工作时,正极a附近的pH将不断增大
C. 负极反应式:ClO﹣﹣2e﹣+H2O═Cl﹣+2 OH﹣
D. b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】已知: (1)Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
![]() 则
则![]() 的ΔH是( )
的ΔH是( )
A.-824.4 kJmol-1B.-627.6kJmol-1C.-744.7kJmol-1D.-169.4kJmol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】将7.8克镁和铝的混合粉末溶于900ml浓度为1mol/L的盐酸中,完全反应可收集到标准状况下气体8.96升,向反应后的混合溶液中逐滴加入2mol/L的氢氧化钠溶液,试计算:
(1)原金属混合物中含铝___g;
(2)当加入___mL氢氧化钠溶液时,Mg2+、Al3+恰好完全沉淀;
(3)当再加入___mL氢氧化钠溶液时,Al(OH)3恰好完全溶解,此时可得沉淀__克。
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2与Cl2的氧化性相近.在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
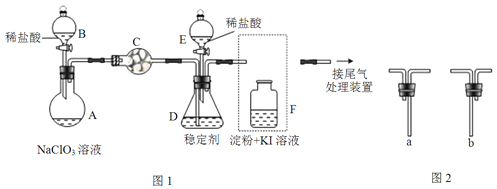
(1)仪器C的名称是__。安装F中导管时,应选用图2中的__。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.该反应中氧化剂与还原剂物质的量之比为__,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜___(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是___。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是___。
(5)已吸收ClO2气体的稳定剂Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是__,原因是__。
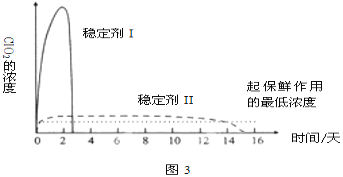
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
(2)从下表中选择,称量NaOH固体所需要的仪器是(填字母)________。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示。
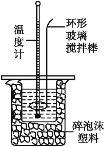
(1)若生成1 mol H2O时反应放出的热量为57.3 kJ,写出该反应的热化学方程式:__________。
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②用上述实验数值计算结果为____kJmol-1,与57.3 kJmol-1有偏差,产生偏差的原因可能是_____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤的烟气中常含有大量的NOx、CO、SO2等有害气体,治理污染、消除有害气体对环境的影响是化学工作者研究的重要课题。
Ⅰ.已知氮氧化物可采用强氧化剂Na2S2O8氧化脱除,过程如下所示:
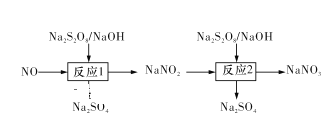
(1)写出反应1的离子方程式:____ 。
(2)反应2为NO2-+S2O82-+2OH-=NO3-+2SO42-+H2O。此反应在不同温度下达到平衡时,NO2-的脱除率与Na2S2O8初始浓度的关系如图1所示。
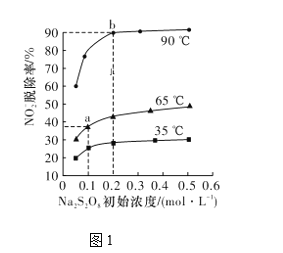
①比较a、b点的反应速率:va正____vb逆(填“>”“<”或“=”)。
②根据图像可以判断该反应为吸热反应,理由是____________。
Ⅱ.沥青混凝土可作为反应2CO(g)+O2(g)![]() 2CO2(g)的催化剂。图2表示在相同的恒容密闭容器、相同的起始浓度、相同的反应时间段下,使用相同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。图2表示在相同的恒容密闭容器、相同的起始浓度、相同的反应时间段下,使用相同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
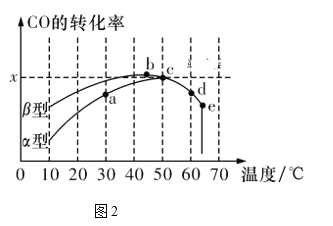
(3)下列关于图2的说法正确的是________。
A.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
B.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
C.a、b、c、d四点中,达到平衡状态的只有b、c两点
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
(4)已知c点时容器中O2浓度为0.02 mol/L,则50 ℃时,在α型沥青混凝土中CO转化反应的平衡常数K=_____________(用含x的代数式表示)。
Ⅲ.利用图3所示装置(电极均为惰性电极)可吸收SO2。
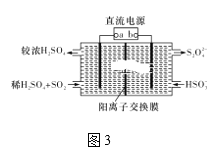
(5)直流电源b极为____,阳极发生的反应为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com