
科目: 来源: 题型:
【题目】某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
⑴写出上述反应的化学方程式______
⑵NaH2PO2为______![]() 填“正盐”或“酸式盐”
填“正盐”或“酸式盐”![]()
⑶已知NaH2PO2水溶液pH > 7,次磷酸的电离方程式为______;NaH2PO2水溶液pH > 7的原因:______。
⑷H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为______![]() 填化学式
填化学式![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其他稀土原料。
(1)写出三价铁离子的外围电子排布图:___,在短周期元素中,与Al的化学性质最相似的元素符号是:___。
(2)实验测得AlCl3的蒸气以二聚分子Al2Cl6的形式存在,已知Al2Cl6分子中Al与Cl交替排列,为非极性分子,Al与Cl均满足8电子稳定结构,则Al2Cl6分子中Al原子采取___杂化,Al2Cl6分子的结构式为:___。
(3)硼(B)元素及与其同周期相邻的两种元素第一电离能由小到大的顺序为:___(用元素符号表示)。
(4)已知AlCl3的熔点为194℃,易升华,AlF3的熔点为1040℃,其原因为:___。
(5)已知立方氮化硼(BN)其晶胞结构类似于金刚石(如图所示),则N的配位数是___,与N原子距离最近的B原子构成的立体构型是___。

若图中b号原子的坐标为(![]() ,
,![]() ,0)写出a原子的坐标___,设晶胞中B、N原子半径分别为pnm、qnm,晶胞边长为rnm,则以a原子为中心形成的最小立方体的空间利用率为___(写代数式即可,不必化简);设晶胞中最近的B、N原子之间的距离为a nm,晶体的密度为bg·cm-3,则阿伏加德罗常数为___mol-1(用含a、b的代数式表示)。
,0)写出a原子的坐标___,设晶胞中B、N原子半径分别为pnm、qnm,晶胞边长为rnm,则以a原子为中心形成的最小立方体的空间利用率为___(写代数式即可,不必化简);设晶胞中最近的B、N原子之间的距离为a nm,晶体的密度为bg·cm-3,则阿伏加德罗常数为___mol-1(用含a、b的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列分子中,各分子的立体构型和中心原子的杂化方式均正确的是( )
A. NH3 平面三角形 sp3杂化 B. CCl4 正四面体 sp3杂化
C. H2O V形 sp2杂化 D. CO32﹣ 三角锥形 sp3杂化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方程式书写正确的是( )
A.HCO3-的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.泡沫灭火器的原理:Al3++3HCO3-![]() Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
C.NH4Cl溶于H2O中:NH4++H2O![]() NH3·H2O+OH-
NH3·H2O+OH-
D.Na2S显碱性原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是由4个碳原子结合成的6种有机物(氢原子没有画出)
![]()
(1) 写出有机物(a)的系统命名法的名称___________________。
(2) 有机物(a)有一种同分异构体,试写出其结构简式__________________。
(3) 上述有机物中与(c)互为同分异构体的是________(填代号)。
(4) 任写一种与(e)互为同系物的有机物的结构简式____________。
(5) 上述有机物中不能与溴反应并使其褪色的有________(填代号)。
(6) (a)(b)(c)(d)四种物质中,4个碳原子一定处于同一平面的有________(填代号)。
查看答案和解析>>
科目: 来源: 题型:
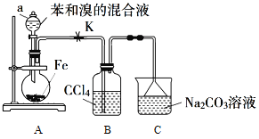
【题目】溴苯是一种重要化工原料,实验室制备溴苯的反应装置如图所示,有关数据如下:
苯 | 溴 | 溴苯 | |
相对分子质量 | 78 | 160 | 157 |
密度/gcm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)仪器a的名称为________
(2)在A装置中加入7.8 mL无水苯、适量液态溴和少量铁屑。实验时装置B中可能的现象为_____,装置C的作用是___________。
(3)反应充分后,取A装置中反应液,经过下列步骤分离提纯:
①向其中加入适量___(填试剂名称),然后____(填操作名称)除去未反应的铁屑;
②滤液依次用水、l0%的NaOH溶液、水洗涤。NaOH溶液洗涤的作用是____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(4)经以上分离操作后,粗溴苯中还含有一定量的杂质,要进一步提纯,下列仪器在该提纯步骤中没有使用到的是____(填入正确选项前的字母)。
A.  B.
B.  C.
C. ![]() D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:

(1)100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___mol·L-1·s-1。
(2)100℃时达到平衡后,改变反应温度为T,N2O4以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T___100℃(填“大于”或“小于”)。
(3)计算温度T时反应的平衡常数K2___(写出必要的计算过程)。
查看答案和解析>>
科目: 来源: 题型:
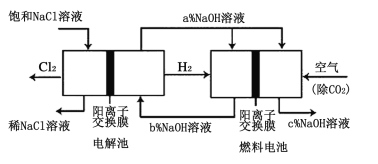
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气和烧碱等化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
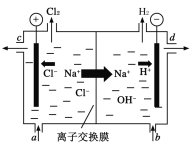
(1)电解饱和食盐水的离子方程式为___。
(2)氢氧化钠溶液从图中___(填“a”、“b”、“c”或“d”)位置流出。
(3)有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出)。通入氢气的电极的电极反应式为___,燃料电池中阳离子的移动方向___(“从左向右”或“从右向左”)。电解池中产生2molCl2,理论上燃料电池中消耗O2的物质的量为___。a、b、c的大小关系为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,下列说法正确的是( )

A.电子由液态Cu-Si合金流出,流入液态铝电极
B.三层液熔盐的作用是使电子能够在三层间自由流动
C.在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
D.液态铝电极与正极相连,作为电解池的阳极
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100mol·L-1盐酸分别滴定10.00mL浓度均为0.100mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH·H2O]=1.6×10-4。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
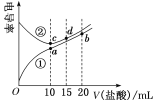
A.曲线②代表滴定二甲胺溶液的曲线
B.a点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
C.d点溶液中:2c(Na+)=3c(Cl-)
D.在相同温度下,a、b、c、d四点的溶液中,水的电离程度最大的是c点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com