
科目: 来源: 题型:
【题目】某稀溶液中含有![]() 、
、![]() 、
、![]() ,向其中逐渐加入铁粉,溶液中
,向其中逐渐加入铁粉,溶液中![]() 的浓度
的浓度![]() 纵坐标
纵坐标![]() 和加入铁粉的物质的量
和加入铁粉的物质的量![]() 横坐标
横坐标![]() 之间的关系如图所示。下列说法正确的是
之间的关系如图所示。下列说法正确的是
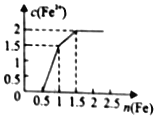
A.三种物质和铁反应的先后顺序依次为![]() 、
、![]() 、
、![]()
B.溶液中![]() 、
、![]() 物质的量浓度之比为4:1
物质的量浓度之比为4:1
C.溶液中![]() 、
、![]() 物质的量浓度之比为1:2
物质的量浓度之比为1:2
D.在此过程中,消耗56gFe可生成![]() 无色气体
无色气体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
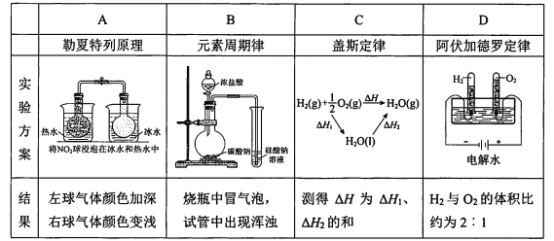
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】用![]() 表示阿伏加得罗常数,下列说法不正确的是
表示阿伏加得罗常数,下列说法不正确的是
A.对于![]() ,每当新形成
,每当新形成![]() 个
个![]() 键,需要断开
键,需要断开![]() 个
个![]() 键
键
B.![]() 熔融的
熔融的![]() 中含有的阳离子数为
中含有的阳离子数为![]()
C.次氯酸光照分解产生![]() 气体
气体![]() 标准状况
标准状况![]() 转移的电子数为
转移的电子数为![]()
D.电解精炼铜时,若阴极析出32g铜,则转移的电子数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
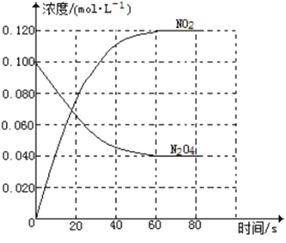
回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1反应的平衡常数K1为___________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____。
②列式计算温度T是反应的平衡常数K2___________
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___________(填“正反应”或“逆反应”)方向移动,判断理由是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO

(1)试剂X为___________________________。
(2)请将提供的装置按合理顺序连接。g→_______________________。
(3)装置B的作用是_______________________。
(4)证明NH3能还原CuO的实验现象是_______________________。
II.探充还原产物的成分
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为_________。 |
若溶液变蓝 | ②证明红色固体肯定含有______,可能含有__________。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量__________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】伞形花内酯的一种制备方法如下:
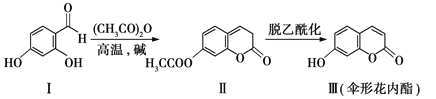
下列说法不正确的是
A.Ⅰ、Ⅱ、Ⅲ均能发生水解反应
B.Ⅰ、Ⅱ、Ⅲ均能使溴水褪色
C.检验化合物Ⅱ中是否混有化合物Ⅰ,可用FeCl3溶液
D.与化合物Ⅰ官能团种类、数目均相同且含有苯环的同分异构体有5种
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W 是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法错误的是
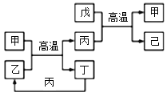
A.W的原子序数是 Z 的两倍,金属性强于Z
B.W元素在周期表中的位置是第四周期VIII族
C.己属于两性氧化物
D.等物质的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.0 | 0.27 | 0.012 |
(1)由表中数据判断ΔH1________(填“>”、“<”或“=”)0;反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3=___________(用ΔH1和ΔH2表示)。
CO(g)+H2O(g) ΔH3=___________(用ΔH1和ΔH2表示)。
(2)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是________(填字母序号)
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂
(3)保持恒温恒容条件对于反应Ⅱ:将10 mol CO2和30mol H2放入1 L的密闭容器中,充分反应后测得CO2的转化率为60%,则该反应的平衡常数为____________________。若维持条件不变向该容器中投入10 mol CO2、30mol H2、10 mol CH3OH(g)和 10mol H2O(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”)。
(4)反应Ⅰ的逆反应速率与时间的关系如图所示。由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:t2时_______________________;t8时______________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向水中通入氯气:Cl2+H2O===2H+ + ClO+ Cl
B. 向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2+ + 2HCO3+2OH===CaCO3↓+CO32+2H2O
C. 向明矾溶液中加过量氨水:Al3++4NH3·H2O===AlO2+4NH4++2H2O
D. 将Fe2O3溶解与足量HI溶液:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.10gH218O中所含的中子数为5NA
B.标准状况2.24L苯在O2中完全燃烧,得到0.6NA个CO2分子
C.常温下,pH=1的NH4NO3溶液,NO3-的数目为0.1NA
D.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com