
【题目】某稀溶液中含有![]() 、
、![]() 、
、![]() ,向其中逐渐加入铁粉,溶液中
,向其中逐渐加入铁粉,溶液中![]() 的浓度
的浓度![]() 纵坐标
纵坐标![]() 和加入铁粉的物质的量
和加入铁粉的物质的量![]() 横坐标
横坐标![]() 之间的关系如图所示。下列说法正确的是
之间的关系如图所示。下列说法正确的是
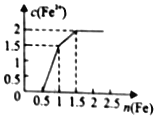
A.三种物质和铁反应的先后顺序依次为![]() 、
、![]() 、
、![]()
B.溶液中![]() 、
、![]() 物质的量浓度之比为4:1
物质的量浓度之比为4:1
C.溶液中![]() 、
、![]() 物质的量浓度之比为1:2
物质的量浓度之比为1:2
D.在此过程中,消耗56gFe可生成![]() 无色气体
无色气体
科目:高中化学 来源: 题型:
【题目】电解质溶液在生产生活中应用十分广泛。回答下列问题:
(1)氯化铁可用作净水剂,其原因是(用离子方程式表示)___。
(2)水玻璃在工业上可作粘合剂,它与NH4Cl溶液接触时,会很快凝结并放出刺激性气味的气体,其原因是(用离子方程式表示)___。
(3)浓度均为0.1mol·L-1的下列各溶液:①HCl ②NaOH ③Na2CO3 ④CH3COONa ⑤NH4Cl ⑥H2SO4 ⑦KCl ⑧CH3COOH,pH由小到大的排列顺序为___。
(4)已知在0.1mol·L-1NaHSO3 溶液中滴入石蕊试液变红,则0.1mol·L-1NaHSO3溶液中离子浓度大小关系为:___。
(5)将mmol/L的醋酸和nmol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=__mol/L,m与n的大小关系是m__n(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用某浓度的NaOH溶液滴定20.00mL等浓度的CH3COOH溶液,所得滴定曲线如下图。下列说法正确的是
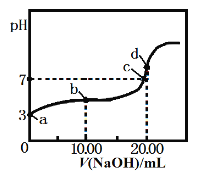
A. a点醋酸的浓度为1.0×10-3mol·L-1
B. a、b两点对应的醋酸电离平衡常数:a<b
C. c点c(Na+):c(CH3COO-)=1:1
D. d点溶液升高温度,溶液pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酪醇是合成药物的中间体。由芳香化合物A为原料制备酪醇的一种合成路线如图:
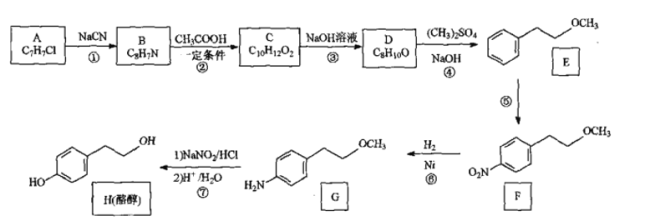
已知:
回答下列回题:
(1)B的结构简式为_____________________。
(2)F中的官能团的名称为__________________。
(3)写出C→D的化学方程式:___________________________。
(4)反应④的反应类型是_______________________________。
(5)反应⑤所需的试剂和条件是_________________________________。
(6)C的一种同分异构体,能发生银镜反应和水解反应,其核磁共振氢谱有4组峰,面积比为6:3:2:1,写出一种符合要求的同分异构体的结构简式:_____________。
(7)已知: ![]() (苯胺)易被氧化。设计以甲苯为原料制备2,4,6一三羟基苯甲酸的合成路线:____________________________________________________ (无机试剂任用)。
(苯胺)易被氧化。设计以甲苯为原料制备2,4,6一三羟基苯甲酸的合成路线:____________________________________________________ (无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伞形花内酯的一种制备方法如下:
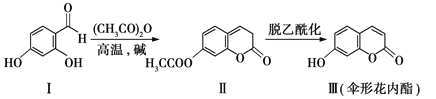
下列说法不正确的是
A.Ⅰ、Ⅱ、Ⅲ均能发生水解反应
B.Ⅰ、Ⅱ、Ⅲ均能使溴水褪色
C.检验化合物Ⅱ中是否混有化合物Ⅰ,可用FeCl3溶液
D.与化合物Ⅰ官能团种类、数目均相同且含有苯环的同分异构体有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下实验测得4g液态甲醇(CH3OH)在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出90.8kJ的热量。试写出甲醇燃烧热的热化学方程式______。
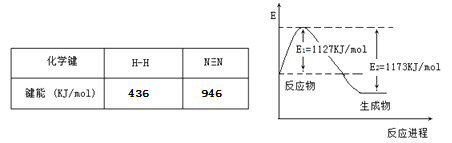
(2)现己知N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化如图所示。根据下列键能数据计算N-H键键能为_____kJmol-1。
(3)用如图所示装置进行中和热测定实验,请回答下列问题:
①仪器A的名称为_______________。
②取50mL0.1molL-1 HCl溶液与50mL0.1molL-1 NaOH溶液在小烧杯中进行中和反应,通过实验并计算可得中和热为54.8kJmol-1,上述实验数值与57.3kJmol-1有偏差,产生此偏差的原因可能是_______(填字母序号)。
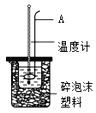
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
c.一次性把NaOH溶液倒入盛有盐酸的小烧杯中
③若用50mL 0.1molL-1 CH3COOH溶液代替HCl溶液进行上述实验,测得反应前后温度的变化值会_____________(填“偏大”、“偏小”、“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果定义有机物的同系列是一系列结构式符合![]() (其中n=0、1、2、3……)的化合物。式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差。同系列化合物的性质往往呈现规律性变化。下列四组化合物中,不可称为同系列的是
(其中n=0、1、2、3……)的化合物。式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差。同系列化合物的性质往往呈现规律性变化。下列四组化合物中,不可称为同系列的是
A.CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3
B.CH3CH=CHCHO CH3CH=CHCH=CHCHO CH3(CH=CH)3CHO
C.CH3CH2CH3 CH3CHClCH2CH3 CH3CHClCH2CHClCH3
D.ClCH2CHClCCl3 ClCH2CHClCH2CHClCCl3 ClCH2CHClCH2CHClCH2CHClCCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:[FeCl4(H2O)2]-为黄色,下列实验所得结论不正确的是( )
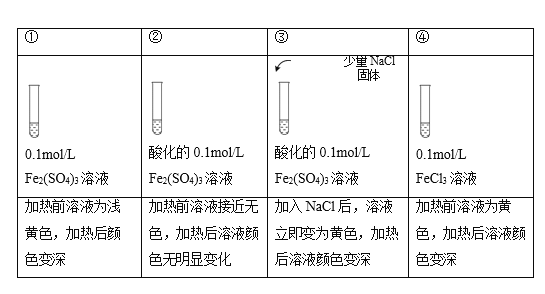
注:加热为微热,忽略体积变化。
A.实验①中,Fe2(SO4)3溶液显浅黄色原因是Fe3+水解产生了少量Fe(OH)3
B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C.实验③中,存在可逆反应: Fe3+ + 4Cl-+ 2H2O ![]() [FeCl4(H2O)2]-
[FeCl4(H2O)2]-
D.实验④,可证明升高温度,Fe3+水解平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
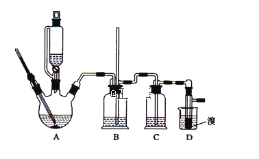
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)写出由乙醇制备乙烯的化学方程式______________________________,乙烯制备1,2-二溴乙烷的化学方程式_______________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___________;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置A中除了浓硫酸和乙醇外,还应加入_____,其目的是_______装置A中生成副产物乙醚的化学反应方程式 ___________________。
(4)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放 ________________,
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液d.品红和酸性KMnO4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_______的方法除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com