
科目: 来源: 题型:
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是I1=738kJ/mol;I2=1451kJ/mol;I3=7733kJ/mol;I4=10540kJ/mol |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的差为4 |
F是前四周期中电负性最小的元素 |
G是第四周期中未成对电子最多的元素 |
(1)已知BA5为离子化合物,写出其电子式_____________。
(2)B基态原子中能量最高的电子,其电子云在空间有_____________个方向,原子轨道呈_____________形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为![]() ,该同学所画的电子排布图违背了_____________。
,该同学所画的电子排布图违背了_____________。
(4)G位于_____________族_____________区,价电子排布式为____。
(5)DE3是________分子(填“极性”或“非极性”),中心原子的杂化方式为_________________,用价层电子对互斥理论推测其空间构型为_________________
(6)检验F元素的方法是____,请用原子结构的知识解释产生此现象的原因是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为___________,基态Ga原子核外有___________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为___________和+3。砷的电负性比镓___________(填“大”或“小”)。
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为___________。

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________。
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以___________键键合。Ga和As的原子半径分别为apm和bpm,设阿伏加德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________(列出计算式,可不化简)。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.将5.85gNaCl晶体溶入100mL水中,制得0.1mol/LNaCl溶液
B.将1体积cmol/L硫酸溶液用水稀释为5体积,得到0.2cmol/L硫酸溶液
C.将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L
D.将wga%NaCl溶液蒸发掉![]() g水,一定得到2a%NaCl溶液
g水,一定得到2a%NaCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度等特性,被美誉为“未来钢铁”“战略金属”。
![]() 基态钛原子核外电子有________种不同的空间运动状态,基态钛原子简化的电子排布式为________,区分晶态
基态钛原子核外电子有________种不同的空间运动状态,基态钛原子简化的电子排布式为________,区分晶态![]() 和非晶态
和非晶态![]() 最可靠的科学方法是对固体进行________。
最可靠的科学方法是对固体进行________。
![]() 钙钛矿
钙钛矿![]() 可应用于发光二极管。与钙元素同周期且最外层电子数相同的元素有种,氧元素可以与氯元素形成化合物
可应用于发光二极管。与钙元素同周期且最外层电子数相同的元素有种,氧元素可以与氯元素形成化合物![]() ,其中氧原子的杂化方式为________,
,其中氧原子的杂化方式为________,![]() 的空间构型为________。
的空间构型为________。
![]() 在浓的
在浓的![]() 的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为
的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为![]() 的绿色晶体,该晶体中两种配体的物质的量之比为
的绿色晶体,该晶体中两种配体的物质的量之比为![]() ,则该配离子的化学式为________。
,则该配离子的化学式为________。
![]() 钛在较高温度下可与氧或氮元素及其化合物发生反应,O、N元素形成的简单氢化物的键角前者小于后者的原因是________。
钛在较高温度下可与氧或氮元素及其化合物发生反应,O、N元素形成的简单氢化物的键角前者小于后者的原因是________。
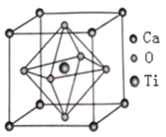
![]() 钛酸钙的晶胞结构如图所示,晶胞中两个最近的氧原子之间的距离为apm,晶胞中钛的氧配位数为________,晶胞的密度为________
钛酸钙的晶胞结构如图所示,晶胞中两个最近的氧原子之间的距离为apm,晶胞中钛的氧配位数为________,晶胞的密度为________![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2,FeCl3的升华温度为315℃。
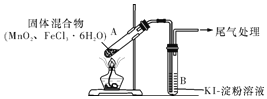
实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是___。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。通过该实验说明现象ⅱ中黄色气体含有___。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
①实验b检出的气体使之变蓝,反应的离子方程式是___。经实验证实推测成立。
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是___。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI淀粉溶液替换为NaBr溶液;检验Fe2+。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色,未检出Fe2+ |
①方案1的C中盛放的试剂是___(填字母)。
A.NaCl饱和溶液 B.NaOH溶液 C.NaClO溶液
②方案2中检验Fe2+的原因是___。
③综合方案1、2的现象,说明选择NaBr溶液的依据是___。
(5)将A中的产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示的实验装置制备少量乙酸乙酯。请回答有关问题:

(1)写出制取乙酸乙酯的化学反应方程式_____________________________。
(2)反应中浓硫酸的作用是①___________________;②__________________________。
(3)实验中应缓慢加热,理由是__________________________________________________。
(4)试管II中的导管口为什么要在液面之上? _________________________________________。
(5)饱和的Na2CO3溶液的主要作用是 ______________
(6)该实验使用的乙醇应不含水份,如何检验乙醇是否含有水份____________________,如果乙醇含有水份,如何将其转变为无水乙醇__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据图示,回答下列问题:

(1)按要求写出下列有机物的分子结构。
乙烯的电子式__________,
乙烷的分子式________,
乙醇的结构式___________,
氯乙烷的结构简式________。
(2)写出②、④两步反应的化学方程式,并注明反应类型
②_______________________,反应类型_______________。
④_______________________,反应类型_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法中正确的是
A.1 mol甲烷的质量与甲烷的摩尔质量相等
B.28 g氮气与40 g氩气所含的原子数目相等,都是NA个
C.2.3 g钠和过量氧气反应,失去的电子数为0.1NA
D.18 g重水(D2O)所含的电子数为10NA
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)写出下列元素的名称:A______, B_______, C________,D__________
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式________________,B元素能量最高的电子为_____轨道上的电子,其轨道呈_______形.
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。
(4)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com