
科目: 来源: 题型:
【题目】常温下,用0.1mol·L-1NaOH溶液滴定新配制的25.0mL0.02 mol·L-1FeSO4溶液,应用手持技术测定溶液的pH与时间(t)的关系,结果如右图所示。下列说法错误的是
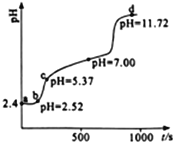
A. ab段,溶液中发生的主要反应:H++OH-=H2O
B. bc段,溶液中c(Fe2+) > (Fe3+) >c(H+)>c(OH-)
C. d点,溶液中的离子主要有Na+、SO42-、OH-
D. 滴定过程发生了复分解反应和氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】有铜和氧化铁的混合物ag,当慢慢滴入![]() 的HCl溶液、边滴边振荡,至50mL时混合物恰好完全溶解,若将ag该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量可能为( )
的HCl溶液、边滴边振荡,至50mL时混合物恰好完全溶解,若将ag该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量可能为( )
A.等于![]()
![]() B.大于
B.大于![]()
![]()
C.大于![]() D.等于
D.等于![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.将0.10 mol·L-1氨水加水稀释后,溶液中c(![]() )·c(OH-)变大
)·c(OH-)变大
B.为确定某酸H2A是强酸还是弱酸,可测H2A溶液与H2SO4溶液的导电性。若导电性比硫酸弱,则H2A是弱酸。
C.将CH3COOH溶液加水稀释后,溶液中 变大
变大
D.用0.200 0 mol·L-1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合溶液中两种酸的浓度均为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
查看答案和解析>>
科目: 来源: 题型:
【题目】铝、钛、钡(第2主族)等元素在能源、材料等领域应用广泛。回答下列问题:
⑴与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有________种。基态Ti2+的最外层电子排布式为________________。
⑵铝的逐级电离能数据为:I1=580 kJmol-1、I2=1820 kJmol-1、I3=2750 kJmol-1、I4=11600 kJmol-1。请分析数据规律,预测钡的逐级电离能的第一个数据“突跃”点出现在________之间(用I1、I2、I3等填空![]() 。
。
⑶已知第ⅡA族元素的碳酸盐MCO3热分解的主要过程是:M2+结合碳酸根离子中的氧离子。则CaCO3、BaCO3的分解温度较高的是________________(填化学式),理由是________________。
⑷催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图1所示。
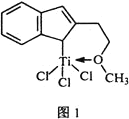
①M中,碳原子的杂化类型有________________。
②M中,不含________![]() 填标号
填标号![]() 。
。
A. π键 B. δ键 C. 配位键 D.氢键 E. 离子键
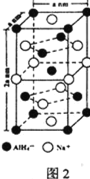
⑸氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图2所示,为长方体。写出与AlH4-空间构型相同的一种分子_______________(填化学式)。NaAlH4晶体中,与AlH4-紧邻且等距的Na+有________个;NaAlH4晶体的密度为________ gcm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2FeO4、Li4YiO12和LiFePO4均可用作电极材料。请回答下列问题:
⑴基态Fe3+的价层电子轨道表达式为________;同周期元素中,基态原子的未成对电子数与基态Fe3+相同的元素为________。
⑵PO43-的空间构型为________,其中P原子的杂化方式为________;写出一种与PO43-互为等电子体且中心原子与P不同主族的阴离子:________(填离子符号)。
⑶[Ti(H2O)6]Cl3为紫色晶体,其中1mol阳离子中所含δ键的数目为________;配位键中提供孤电子对的原子为________(填元素符号)。
⑷已知物质间的转化关系如图甲所示,其中a、c均大于0。
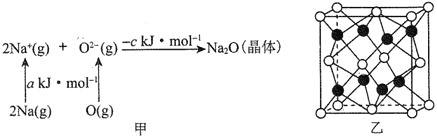
①基态Na原子的第一电离能可表示为________。
②相同条件下,Li2O的晶格能________(填“>”“<”或“=”)ckJmol-1,原因为________________________________。
③Na2O的立方晶胞结构如图乙所示。若紧邻的两个Na+之间的距离为d pm,阿伏加德罗常数的值为NA,晶体的密度为ρ gcm-3,则Na的摩尔质量可表示为_______gmol-1(用含有d、ρ、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 4NO2(g)+ O2(g) △H >0, T1温度下的部分实验数据为
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A.500s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1000s时N2O5转化率为50%
C.T1温度下的平衡常数为K1 ,T2温度下的平衡常数为K2,若K1<K2,则T1 >T2
D.平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时c(N2O5) >5.00mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示。下列叙述正确的是( )
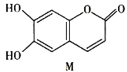
A.常温下,能与Na2CO3溶液反应放出CO2
B.1mol M最多能与2mol Br2发生反应
C.M与足量的NaOH溶液反应时,所得有机产物的化学式为C9H4O5Na4
D.该有机物不能使FeCl3溶液显紫色
查看答案和解析>>
科目: 来源: 题型:
【题目】1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】东晋![]() 华阳国志
华阳国志![]() 南中志
南中志![]() 卷四中已有关于白铜的记载,云南镍白铜
卷四中已有关于白铜的记载,云南镍白铜![]() 铜镍合金
铜镍合金![]() 闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)已知:丁二酮肟[HON=(CH3)CC(CH3)=NOH]是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为___,1mol丁二酮肟分子所含σ键的数目为___。
(2)单质铜及镍都是金属晶体;铜晶体的堆积方式为___;元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是___。
(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图(1)。写出该反应的化学方程式:___。

(4)下列关于铁和镍及其化合物说法正确的是___
a.金属镍能与CO形成配合物Ni(CO)4,常温下为液态,易溶于CCl4、苯等有机溶剂。所以Ni(CO)4固态时属于分子晶体
b.[Ni(NH3)6]SO4中阴离子的立体构型是正八面体
c.Ni2+和Fe2+的半径分别为69pm和78pm,则晶格能NiO>FeO,熔点NiO>FeO
d.铁晶胞结构见图(2),每个晶胞含有2个铁原子
(5)配合物Y的结构见图(3),Y中含有的化学键有___![]() 填序号
填序号![]() ;
;
a.极性共价键 b.非极性共价键 c.配位键 d.氢键 e.离子键 f.金属键
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学科研小组在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)![]() cC(g)表示]的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
cC(g)表示]的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
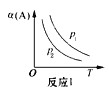



A.反应I:若p1>p2,则此反应只能在高温下自发进行
B.反应Ⅱ:此反应的△H<0,且T1<T2
C.反应Ⅲ:表示t1时刻一定是使用催化剂对反应速率的影响
D.反应Ⅳ:表示t1时刻增大B的浓度对反应速率的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com