
科目: 来源: 题型:
【题目】某兴趣小组探究![]() 气体还原
气体还原![]() 、
、![]() ,他们使用的药品和装置如图所示,下列说法正确的是()
,他们使用的药品和装置如图所示,下列说法正确的是()
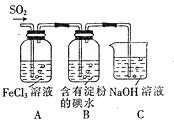
A.![]() 是
是![]() 气体与
气体与![]() 反应的还原产物
反应的还原产物
B.装置C烧杯中加入少量苯可以防止倒吸
C.表明![]() 的还原性弱于
的还原性弱于![]() 的现象是B中溶液蓝色褪色
的现象是B中溶液蓝色褪色
D.在A中的溶液加入![]() 溶液,则紫红色褪去说明A中
溶液,则紫红色褪去说明A中![]() 与
与![]() 发生了氧化还原反应
发生了氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2 ②CH3CH2CH=CH2 ③![]() ④CH3CH3
④CH3CH3
A. ①②③④B. ②③C. ②④D. ①②
查看答案和解析>>
科目: 来源: 题型:
【题目】多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:
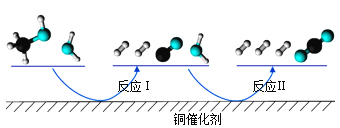

下列说法正确的是( )
A.反应Ⅱ的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g) △H=+akJ/mol(a>0)
B.1molCH3OH(g)和1molH2O(g)的总能量大于1molCO2(g)和3molH2(g)的总能量
C.选择优良的催化剂降低反应Ⅰ和Ⅱ的活化能,有利于减少过程中的能耗
D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】某离子反应中涉及![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种微粒,其中
六种微粒,其中![]() 的物质的量随时间变化的曲线如图所示。下列判断正确的是
的物质的量随时间变化的曲线如图所示。下列判断正确的是
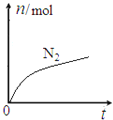
A. 该反应的氧化剂ClO-,还原产物是![]() B. 消耗1mol还原剂,转移6mol电子
B. 消耗1mol还原剂,转移6mol电子
C. 水是生成物,且反应后溶液的酸性明显增强 D. 氧化剂与还原剂的物质的量之比为2:3
查看答案和解析>>
科目: 来源: 题型:
【题目】由 N2O 和 NO 反应生成 N2 和 NO2 的能量变化如图所示。下列说法不正确的是
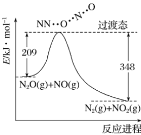
A.反应生成 1 mol N2 时转移 2 mol e-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139 kJ·mol-1
D.断键吸收能量之和大于成键释放能量之和
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组学习过氧化钠与水的反应时,向滴有酚酞的水中加入过氧化钠,发现溶液先变红后褪色,对此产生兴趣并进行研究。
(1)写出Na2O2与水反应的化学方程式:______。
(2)甲同学查阅资料:红色褪去的原因是H2O2在碱性条件下氧化了酚酞。
①甲同学通过实验证实了Na2O2与水反应所得溶液中有较多的H2O2:取少量反应所得溶液,加入试剂______(填化学式),有气体产生。
②甲同学利用3% H2O2溶液、酚酞试液、1mol·L-1 NaOH溶液,证实了碱性条件是必需的。
操作 | 现象 | |
实验1 | 向2mL 3%H2O2溶液中加入3滴酚酞试液,振荡,静置5min,再加入5滴1mol·L-1 NaOH溶液 | 观察到______。 |
(3)为了更深入地了解该原理,甲同学继续查阅资料,发现H2O2溶液中相关微粒的物质的量分数X(i)与溶液pH的关系如图所示。
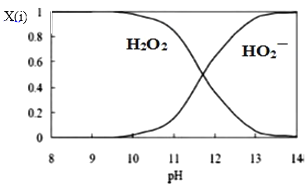
据此,甲同学设计实验2继续研究:
操作 | 现象 | |
实验2 | i.配制20mL 3%H2O2与NaOH的混合溶液,调节pH分别为10~14。 ii.滴入3滴酚酞试液,搅拌后静置,记录酚酞完全褪色的时间 | 得到如图所示实验结果:
|
甲同学由此提出假设I:溶液褪色的主要原因是酚酞被HO![]() 氧化,请结合化学反应速率和化学平衡的相关知识解释此假设:_____。
氧化,请结合化学反应速率和化学平衡的相关知识解释此假设:_____。
(4)乙同学查阅资料,发现酚酞(以H2L表示)在不同pH条件下存在多种结构之间的变化:
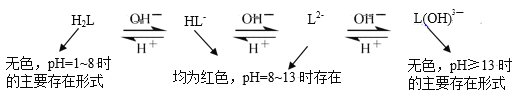
由此提出,甲同学实验2中pH13时红色褪去的原因还存在假设II:_____。
(5)针对假设I、II,小组同学设计了如下实验:
试剂加入顺序 | 现象 | |
实验3 | i.烧杯中加入10mL 2mol·L-1 NaOH溶液、8mL H2O ii.加入3滴酚酞试液 | 溶液变红,然后褪色 |
iii.搅拌、静置后加入2mL 30% H2O2溶液 | _____ | |
iv.向褪色后的溶液中加入盐酸调节pH至12 | 溶液变红,然后褪色 | |
实验4 | i.烧杯中加入10mL 2mol·L-1 NaOH溶液、8mL H2O ii.加入2mL 30% H2O2溶液 iii.搅拌、静置后加入3滴酚酞试液 | 溶液变红,然后褪色 |
iv.向褪色后的溶液中加入盐酸调节pH至12 | 不变红 |
①与L2-和HL-相比较,L(OH)![]() 比前两者更_____被氧化(填“难”或“易”)。
比前两者更_____被氧化(填“难”或“易”)。
②实验3中调节pH至12,溶液变红然后褪色的原因是:_____。
③根据实验得出结论:甲同学实验2中pH13时红色褪去的主要原因是_____(填“假设I”或“假设II”),请依据实验现象阐述理由:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如图所示(部分反应条件已略去)。

已知;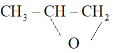 与
与![]() 反应生成
反应生成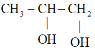 。
。
(1)A的化学名称是________________。
(2)B和A反应生成C的化学方程式为________________,该反应的类型为________________。
(3)D的结构简式为________________。
(4)F的结构简式为________________。
(5)D的同分异构体的结构简式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)“84”消毒液是一种常用的消毒剂,其有效成分是______(填化学式)。某学生用石墨作电极电解饱和氯化钠溶液,制作了一种家用环保型消毒液发生器,如图所示。电极c处发生反应的离子方程式依次为:2H2O+2e-=H2↑+2OH-;_____。
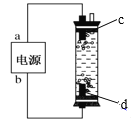
(2)“84”消毒液工业品中常含有1.5%~3%的NaOH,其目的一是使平衡_____(写出离子方程式)向逆方向移动;二是吸收空气中的_____(填化学式)防止消毒液失效。
(3)消毒液中氯元素的存在形态与溶液pH的关系如下:
溶液pH | >9 | 5~6 | 4~5 | 2~3 | <2 |
主要成分 | NaClO | HClO与NaClO(少量) | HClO与Cl2(少量) | HClO与Cl2 | Cl2 |
请你写出pH降低时产生氯气的离子方程式:_____。
(4)某同学猜测“84消毒液”(以下简称“84”)可以“漂白”米醋,进行了实验1和实验2:
编号 | 实验操作 | 实验现象 |
实验1 |
滴加2滴米醋,5滴管“84” | 溶液无色,闻到刺激性气味 |
实验2 |
滴加2滴米醋,5滴管蒸馏水 | 溶液为浅棕色,无刺激性气味 |
实验2的目的是:①______;②______。
为进一步研究“84”与米醋的反应,该同学又进行了以下实验:
编号 | 实验操作 | 实验现象 |
实验3 |
逐滴加入“84”,10滴米醋 | “84”滴入后迅速产生刺激性气味的气体;滴加至5滴时,溶液开始褪色;滴加至21滴时,褪为淡黄色;继续滴加不再出现明显褪色。 |
实验4 |
逐滴加入米醋,21滴“84” | 滴入米醋后立即褪色;当米醋滴加至10滴时,溶液较实验3颜色更浅;当米醋加至17滴时,与实验3中溶液最终颜色相同。 |
请你结合上述实验和相关资料,分析实验3与实验4现象的差异:______。
(5)某工厂使用次氯酸钠漂白棉布,该工厂对生产条件进行了研究,结果如图所示:
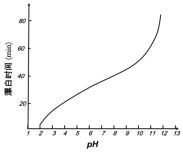
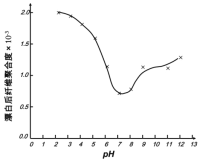
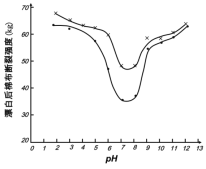
查阅资料得知:次氯酸钠对纤维素的破坏分为两个阶段进行。第一阶段:纤维素纤维的羟基与次氯酸作用生成次氯酸酯;第二阶段:生成的次氯酸酯在OH-离子作用下,失去一分子氯化氢,并转变为醛或酮,直接影响纤维素化学键的稳定性。
①当溶液pH=7时,纤维聚合度最低,纤维损伤最严重的原因是:_____。
②综合考虑,生产过程中pH最好选择_____,理由是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾石经处理后得到明矾( KAl(SO4)2·12H2O)。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
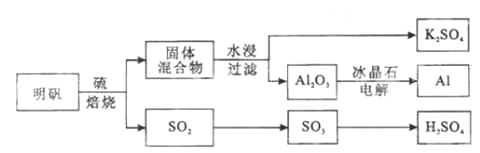
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是__________________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是_____________________。
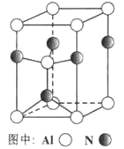
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是____。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是_____________________________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g)![]() 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是__________________________。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在O2中的燃烧反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com