
科目: 来源: 题型:
【题目】(1)室温下在pH =5的醋酸稀溶液中, 醋酸电离出的c(H+)的精确值是__molL-1,水电离出的c(H+)是__molL-1。
(2)写出下列反应的离子方程式:①草酸溶液中滴入酸性高锰酸钾溶液___;
②铬酸钾溶液中滴入稀硫酸___;
(3)反应I2+2S2O32-=2I-+S4O62-常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择___(填序号)。
①1mL0.01molL-1的碘水 ②1mL0.001molL-1的碘水
③4mL0.01molL-1的Na2S2O3溶液 ④4mL0.001molL-1的Na2S2O3溶液
若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32-)=__。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化合物既与硫酸反应,又与氢氧化钠反应的是( )
①NaHCO3 ②NaHSO4 ③(NH4)2CO3 ④NaNO3 ⑤Al(OH)3
A.只有①B.只有③C.①②③D.①③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个固定体积的密闭容器中,加入4molA和2molB发生反应:2A(g)+B(g)![]() 3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
A. 4molA+2molB
B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB
D. 3molC+1molD
查看答案和解析>>
科目: 来源: 题型:
【题目】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | ⅠB族,其单质常用作导线 |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是_____________________,M2+的核外电子排布式为________________________。
(2)写出两个与YZ2互为等电子体的化学式_________________ 。
(3)WZ2分子中W原子价层电子对数是_____________对,WZ2的VSEPR 模型名称为_______________,WZ3气态为单分子,该分子中W原子的杂化轨道类型为__________________;WZ3的三聚体环状结构如图所示,该结构中W原子的杂化轨道类型为__________;该结构中W-Z键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为___________(填图中字母) ,该分子中含有______个σ键。
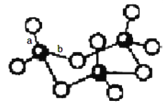
查看答案和解析>>
科目: 来源: 题型:
【题目】现有容积为1L的甲乙两个恒温恒容密闭容器,向甲中加入2molA气体和2molB气体后发生如下反应:![]() ,反应达到平衡状态时生成1molC气体,放出热量
,反应达到平衡状态时生成1molC气体,放出热量![]() ;乙中加入1molC气体,反应达到平衡时,吸收热量
;乙中加入1molC气体,反应达到平衡时,吸收热量![]() ,则
,则![]() 与
与![]() 的相互关系正确的是( )
的相互关系正确的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是
A. 2gD2O和H2l8O混合物中所含中子数为NA
B. 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C. 常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA
D. 0.1 mol H2和0.1 mol I2 (g)于密闭容器中充分反应,其原子总数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】1911年,科学家发现汞在4.2K以下时电阻突然趋近于零——即低温超导性。1986年,科学家又发现了Nb3Ge在23K下具有超导性。1987年2月,赵忠贤及合作者独立发现了在液氮温区(沸点77 K)的高温超导体,其晶胞如图所示,元素组成为Ba-Y-Cu-O(临界温度93 K),推动了国际高温超导研究。赵忠贤院士获得2016年度国家最高科学技术奖。

回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于_______族。
(2)下列关于Ge元素叙述正确的是______(从下列选项中选择)。
A.Ge晶体属于准金属,且为原子晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是______________。
(4)NH3也常作致冷剂,其键角_______(填“大于”或“小于”)109°28′,主要原因是___________________________________________________________________________。
(5)图示材料的理想化学式(无空位时)为___________________,若Y(钇)元素的化合价为+3,则Cu的平均化合价为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一固定容积的密闭容器中充入2molA和1molB,发生反应:2A(气)+B(气) ![]() xC(气),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为
xC(气),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.在密闭容器中进行下列反应:CO2(g)+C(s)![]() 2CO(g) ΔH>0,达到平衡后,若改变下列条件,则平衡如何移动?(填“向左移动”、“向右移动”或“不移动”)
2CO(g) ΔH>0,达到平衡后,若改变下列条件,则平衡如何移动?(填“向左移动”、“向右移动”或“不移动”)
(1)增加C(s),平衡___。
(2)减小密闭容器容积,保持温度不变,则平衡___。
(3)通入N2,保持密闭容器容积和温度不变,则平衡__。
(4)保持密闭容器容积不变,升高温度,则平衡__。
Ⅱ.在一密闭容器中发生下列反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,如图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g) ΔH<0,如图是某一时间段反应速率与反应进程的关系曲线图。
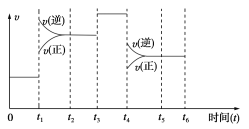
下列时间段中,氨的百分含量最高的是(_____)
A.0~t1 B.t2~t3
C.t3~t4 D.t4~t5
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为_____________________________。
(2)下列关于CH4和CO2的说法正确的是_______________(填序号)。
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”

分子 | 分子直径 | 分子与H2O 的结合能E(kJ/mol) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中分子间存在的2种作用力是_______________________________________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com