
科目: 来源: 题型:
【题目】某烃A的相对分子质量为84。请回答下列问题:
(1)下列物质与A以任意比例混合,只要总物质的量一定,充分燃烧消耗氧气的量不变的是(填字母)________。
a.C7H12O2b.C6H14 c.C6H14O d.C7H14O3
(2)若A是链烃且分子中所有的碳原子共平面,该分子的一氯取代物只有一种,则A的结构简式为__________________。
(3)若A是链烃且其1H核磁共振谱有三组不同的峰,峰值比为3∶2∶1,则A的名称为__________。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中有可逆反应:![]() ;
;![]() 处于平衡状态
处于平衡状态![]() 已知
已知![]() ,则下列说法正确的是
,则下列说法正确的是![]()
①升温时![]() 的值减小②降压时体系内混合气体的平均相对分子质量减小③加入B,A的转化率变大④加入催化剂,气体的总物质的量不变⑤充入C,则A、B的物质的量增大
的值减小②降压时体系内混合气体的平均相对分子质量减小③加入B,A的转化率变大④加入催化剂,气体的总物质的量不变⑤充入C,则A、B的物质的量增大
A.③④B.①②⑤C.②③⑤D.全部
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物键线式结构的特点是以线示键,每个折点和线端点处表示有一个碳原子,并以氢补足四价,C、H不表示出来。降冰片烷立体结构如图所示:
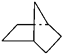
(1)写出其分子式____________。
(2)当降冰片烷发生一氯取代时,能生成_____________种沸点不同的产物。
(3)根据降冰片烷的键线式结构,请你判断:降冰片烷属于______________________。
a.环烷烃 b.饱和烃 c.不饱和烃 d.芳香烃
(4)降冰片烷具有的性质是__________________。
a.能溶于水 b.能燃烧 c.能使酸性高锰酸钾溶液褪色
d.能发生加成反应 e. 能发生取代反应 f. 常温常压下为气体
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列各组物质:(A)O2和O3;(B)23592U和23892U;(C) CH3CH2CH2CH3和 ;(D)
;(D) 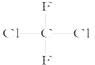 和
和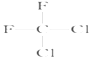 ;(E)甲烷和新戊烷。
;(E)甲烷和新戊烷。
(1)__________组两物质互为同位素;
(2)__________组两物质互为同素异形体;
(3)__________组两物质互为同系物;
(4)__________组两物质互为同分异构体。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温密闭容器中发生反应:CaCO3(s)![]() CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是
CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是

A. υ逆(逆反应速率) B. ρ(容器内气体密度)
C. m(容器内CaO质量) D. Qc(浓度商)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应![]() ,在某温度下的平衡常数为400。此温度下,在密闭容器中加入
,在某温度下的平衡常数为400。此温度下,在密闭容器中加入![]() ,反应进行到某时刻测得各组分的浓度如下:
,反应进行到某时刻测得各组分的浓度如下:
物质 |
|
|
|
浓度 |
|
|
|
下列叙述中正确的是![]()
A.该反应的平衡常数表达式为 ![]()
B.该时刻正、逆反应速率的大小:![]()
C.平衡时![]()
D.若加入![]() 后,经
后,经![]() 反应达到平衡,该时间内反应速率
反应达到平衡,该时间内反应速率![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知气态烃A的产量是一个国家石油化工水平的重要标志,有机物A~E能发生如图所示一系列变化,则下列说法正确的是( )
![]()
A.A→B的反应类型为加成反应
B.常温下有机物C是一种有刺激性气味的气体
C.分子式为C4H8O2的酯有3种
D.l mol D与足量碳酸氢钠反应生成气体的体积为22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】氯碱工业中电解饱和食盐水的原理示意图如图:
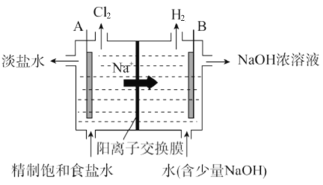
(1)电极 A 是_________(填“阴极”或“阳极”),判断依据为_________。
(2)写出电极 B 的电极反应式_________。
(3)写出电解饱和食盐水的化学方程式_________。
(4)一段时间后,电极 B 周围 NaOH 稀溶液转变为浓溶液,原因:_________。
(5)电解时,工业用盐酸调节 A 室的 pH=2~3,请用化学平衡原理解释原因_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
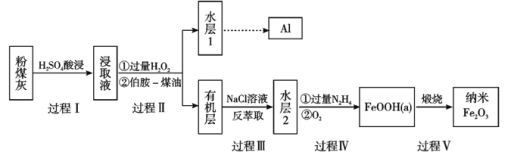
已知:
i)伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
ii)Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-,回答下列问题:
[FeCl6]3-,回答下列问题:
(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是_____________。
(2)写出过程Ⅱ加入过量H2O2发生的离子方程式_____________。加入伯胺-煤油对浸取液进行分离,该操作的名称是_____________。
(3)从化学平衡角度解释过程Ⅲ利用NaCl溶液进行反萃取的原理_____________。
(4)过程Ⅳ中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl-,该反应中氧化剂与还原剂的物质的量之比为_______________。
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:
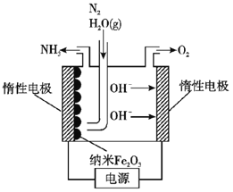
第一步:Fe2O3+3H2O+6e-=2Fe+6OH-;
第二步:2Fe+N2+3H2O=Fe2O3+2NH3。
则该电解池发生总反应的化学方程式为___________________________________,纳米Fe2O3在电解过程中所起的作用是___________________________________。
(6)某特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3),若x平均值为1.3,则磁流体中Fe3+和Fe2+的质量之比为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,将锌片和铜片按不同方式插入稀硫酸中,下列说法正确的是( )
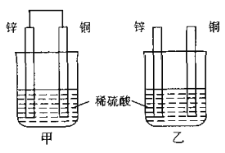
A. 甲中电子经导线从铜片流向锌片
B. 两烧杯中锌片上均发生还原反应
C. 两烧杯中铜片表面均无气泡产生
D. 一段时间后,两烧杯中溶液的c(H+)均减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com