
科目: 来源: 题型:
【题目】沉淀碳酸钙主要用于食品、医药等行业。以精选石灰石![]() 含有少量
含有少量![]() 、
、![]() 杂质
杂质![]() 为原料制备沉淀碳酸钙的工艺流程如下:
为原料制备沉淀碳酸钙的工艺流程如下:
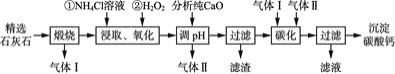
![]() 流程中可以循环利用的物质有气体 Ⅰ、气体Ⅱ和____
流程中可以循环利用的物质有气体 Ⅰ、气体Ⅱ和____![]() 填化学式
填化学式![]() 。
。
![]() “碳化”时发生反应的离子方程式为 ______________,该过程中通入气体Ⅰ和气体Ⅱ的顺序是________。
“碳化”时发生反应的离子方程式为 ______________,该过程中通入气体Ⅰ和气体Ⅱ的顺序是________。
![]() 工业上常用电解氯化钠和氯化钙熔融物来制备金属钠,原理如下图所示:
工业上常用电解氯化钠和氯化钙熔融物来制备金属钠,原理如下图所示:
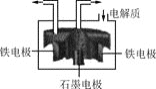
![]() 电解过程中,加入氯化钙的目的是________。
电解过程中,加入氯化钙的目的是________。
![]() 石墨电极发生的电极反应为________。
石墨电极发生的电极反应为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验:①将![]() 溶液和
溶液和![]() 溶液等体积混合得到浊液;②取少量①中浊液,滴加
溶液等体积混合得到浊液;②取少量①中浊液,滴加![]() 溶液,出现红褐色沉淀;③将①中浊液过滤取少量白色沉淀,滴加
溶液,出现红褐色沉淀;③将①中浊液过滤取少量白色沉淀,滴加![]() 溶液.沉淀变为红褐色。下列说法中,不正确的是 ( )
溶液.沉淀变为红褐色。下列说法中,不正确的是 ( )
A. 将①中浊液过滤,所得滤液中含少量![]()
B. ①中浊液存在平衡:![]()
C. ②中沉淀颜色变化说明![]() 转化为
转化为![]()
D. ③可以证明![]() ,比
,比![]() 更难溶
更难溶
查看答案和解析>>
科目: 来源: 题型:
【题目】钼酸钠晶体![]() 是无公害型冷却水系统的金属缓蚀剂,由钼精矿
是无公害型冷却水系统的金属缓蚀剂,由钼精矿![]() 主要成分是
主要成分是![]() ,含少量PbS等
,含少量PbS等![]() 制备钼酸钠晶体的部分流程如图所示
制备钼酸钠晶体的部分流程如图所示
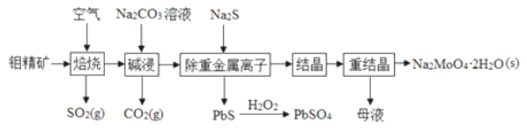
![]() 中钼元素的化合价为__________。
中钼元素的化合价为__________。
![]() 焙烧时为了使钼精矿充分反应,可采取的措施是__________
焙烧时为了使钼精矿充分反应,可采取的措施是__________![]() 答出一条即可
答出一条即可![]() 。
。
![]() 焙烧过程中钼精矿发生的主要反应的化学方程式为
焙烧过程中钼精矿发生的主要反应的化学方程式为![]() 未配平
未配平![]() ,该反应中氧化产物是__________
,该反应中氧化产物是__________![]() 填化学式
填化学式![]() ;当生成
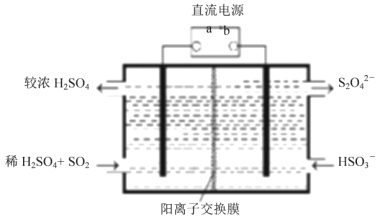
;当生成![]() 时,该反应转移的电子的物质的量为__________mol。利用下图所示装置
时,该反应转移的电子的物质的量为__________mol。利用下图所示装置![]() 电极均为惰性电极
电极均为惰性电极![]() 也可吸收
也可吸收![]() ,并用阴极排出的溶液吸收
,并用阴极排出的溶液吸收![]() 。阳极的电极反应式为__________,在碱性条件下,用阴极排出的溶液吸收
。阳极的电极反应式为__________,在碱性条件下,用阴极排出的溶液吸收![]() ,使其转化为无害气体,同时有
,使其转化为无害气体,同时有![]() 生成,该反应的离子方程式为______。
生成,该反应的离子方程式为______。
![]() 碱浸时,
碱浸时,![]() 与
与![]() 溶液反应的离子方程式为___________。
溶液反应的离子方程式为___________。
![]() 重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______。
重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______。
![]() 过滤后的碱浸液结晶前需加入
过滤后的碱浸液结晶前需加入![]() 固体以除去
固体以除去![]() ,当
,当![]() 开始沉淀时,
开始沉淀时, ![]() 去除率为
去除率为![]() ,已知碱浸液中
,已知碱浸液中![]() ,
,![]() ,
,![]() 、则
、则![]() ___________
___________![]() 加入
加入![]() 固体引起的溶液体积变化可忽略
固体引起的溶液体积变化可忽略![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,用蒸馏水稀释1 mol/L氨水至0.01 mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A.![]() B.c(H+)·c(OH-)
B.c(H+)·c(OH-)
C.![]() D.c(OH-)
D.c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。某铜沉淀渣,其主要成分如表。沉淀渣中除含有铜![]() 、硒
、硒![]() 、碲
、碲![]() 外,还含有少量稀贵金属,主要物质为Cu、
外,还含有少量稀贵金属,主要物质为Cu、![]() 和
和![]() 。某铜沉淀渣的主要元素质量分数如下:
。某铜沉淀渣的主要元素质量分数如下:
Au | Ag | Pt | Cu | Se | Te | |
质量分数 |
|
|
|
|
|
|
![]() 、
、![]() 、
、![]() 为同主族元素,其中
为同主族元素,其中![]() 在元素周期表中的位置_________。其中铜、硒、碲的主要回收流程如下:
在元素周期表中的位置_________。其中铜、硒、碲的主要回收流程如下:
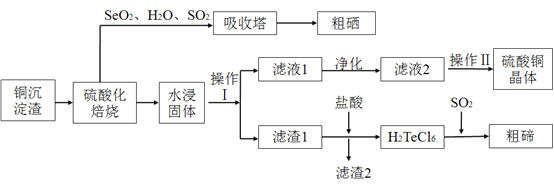
![]() 经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:
经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:![]() ____
____![]()
![]()
![]() ____
____![]() ____
____![]() ____
____![]()
![]() 与吸收塔中的
与吸收塔中的![]() 反应生成亚硒酸。焙烧产生的
反应生成亚硒酸。焙烧产生的![]() 气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为____________ ;
气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为____________ ;
![]() 沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。滤液2经过_____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。滤液2经过_____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
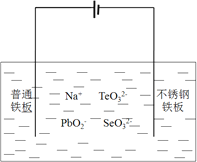
![]() 目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着
目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着![]() 浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为__________。
浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如图1:
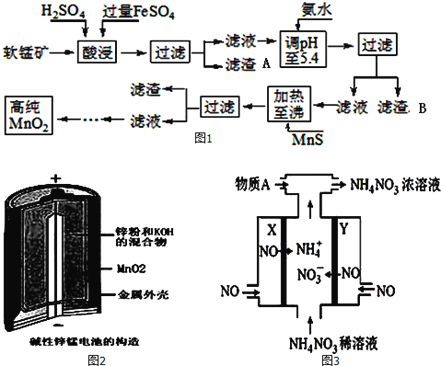
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH如表,回答下列问题
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为__________;
(2)滤渣A的主要成分是____________;滤渣B的主要成分是__________________;
(3)加入MnS的目的是除去Cu2+、Zn2+杂质,可能原因是_________________;
(4)碱性锌锰电池是一种一次性电池,其结构如图2所示.该电池放电过程产生MnOOH.该电池的正极反应式为________________,电池总反应的方程式为_______________________;
(5)利用该碱性锌锰电池电解NO制备NH4NO3,其工作原理如图3所示,X电极__________极,电解时阳极的电极反应为________________,使电解产物全部转化为NH4NO3,需补充物质A,A是__________;
查看答案和解析>>
科目: 来源: 题型:
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某学习小组模拟化工生产设计了如下流程制备精铜。

已知:Cu2O + 2 H+ = Cu + Cu2+ + H2 O
回答下列问题:
(1)实际生产中,常将铜矿石粉碎的目的是______________________________。
(2)滤渣1中含有较多的铜,提纯滤渣1时反应的离子方程式为_______________________________。
(3)滤液1中铁元素的存在形式为______________(填离子符号),检验该离子的常用试剂为________________。
(4)写出加入铝粉时生成铜的化学方程式:______________________________。
(5)“电解”精炼过程中,粗铜与外接电源的___________极相连;阴极的电极反应式为__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在相同温度下,有两种较稀的醋酸溶液A和B。A溶液中c(CH3COOH)=a mol·L-1,电离度为α1,B溶液中c(CH3COO-)=a mol·L-1,电离度为α2。下列叙述中正确的是( )
A.B溶液中c(CH3COOH)= ![]() mol·L-1
mol·L-1
B.A溶液的pH值小于B溶液的pH值
C.α2>α1
D.A溶液的c(H+)是B溶液c(H+)的0.5α1倍
查看答案和解析>>
科目: 来源: 题型:
【题目】在一真空密闭容器中盛有1 mol PCl5,加热到200 ℃,发生反应:PCl5(g) ![]() PCl3(g)+Cl2(g),反应达到平衡时,PCl5在混合气体中的体积分数为m%,若在相同的温度和相同的容器中,起始时加入2 mol PCl5,反应达到平衡时,PCl5在混合气体中的体积分数为n%,则m和n的关系正确是( )
PCl3(g)+Cl2(g),反应达到平衡时,PCl5在混合气体中的体积分数为m%,若在相同的温度和相同的容器中,起始时加入2 mol PCl5,反应达到平衡时,PCl5在混合气体中的体积分数为n%,则m和n的关系正确是( )
A.m>nB.m<nC.m=nD.无法比较
查看答案和解析>>
科目: 来源: 题型:
【题目】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+要使溶液中
CH3COO-+H+要使溶液中![]() 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
A.加少量烧碱溶液B.降低温度
C.加少量冰醋酸D.加水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com