
科目: 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验过程中pH变化如图所示,下列有关叙述正确的是
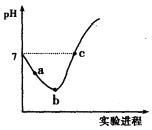
A.实验进程中可用pH试纸测定溶液的pH
B.a点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)
C.c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D.由a点到b点的过程中,溶液中![]() 减小
减小
查看答案和解析>>
科目: 来源: 题型:
【题目】I.下图是X、Y、Z三种固体物质的溶解度曲线。按要求回答下列问题:
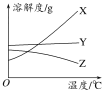
(1)若X溶液中混有少量Y,提纯X的操作_______;
(2)若Y溶液中混有少量的X,提纯Y的操作______。
II.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
84消毒液
有效成分 NaClO
规格 1 000 mL
质量分数 25%
密度 1.19 g·cm-3
(1)该“84消毒液”的物质的量浓度约为_______mol·L-1。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=_____mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是__(填字母)。
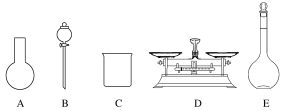
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为______mol·L-1。
②需用浓硫酸的体积为________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-= BaSO4↓
B. 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
C. SiO2和氢氧化钠溶液的反应:SiO2+2OH-=SiO32-+H2O
D. 用FeCl3溶液腐蚀铜箔制造印刷电路板:Fe3++Cu=Fe2++Cu2+
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
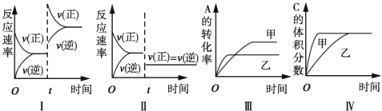
A. 图I表示增加反应物浓度对该平衡的影响
B. 图II表示减小压强对该平衡的影响
C. 图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D. 图IV表示催化剂对该平衡的影响,催化效率:甲>乙
查看答案和解析>>
科目: 来源: 题型:
【题目】用质量分数为98%的浓硫酸(ρ=1.84 g·cm-3)配制240 mL 1.84 mol·L-1稀硫酸,下列操作正确的是
A.将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却
B.必需的定量仪器有50 mL量筒、250 mL容量瓶和托盘天平
C.量取浓硫酸的体积为25.0 mL
D.先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 0.1 mol Fe在0.1 mol氯气中充分燃烧时转移的电子数为0.3NA
B. 0.1 mol乙烷和丙烯的混合物所含氢原子数目为0.6NA
C. 64 g的SO2与足量的O2充分反应后可得到NA个SO3分子
D. 标准状况下,2.24 L四氯化碳含有的分子数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.50mL 12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
B.56g铁片投入足量浓H2SO4中生成NA个SO2分子
C.2mol SO2和1mol O2在一定条件下充分反应后,混合物中SO3的分子数小于2NA
D.标准状况下,22.4L NO2气体中所含分子数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池和液晶显示器制造中得到广泛应用。![]() 是一种三角锥型分子,键角
是一种三角锥型分子,键角![]() ,沸点
,沸点![]() ;可在铜的催化作用下由
;可在铜的催化作用下由![]() 和过量
和过量![]() 反应得到:
反应得到: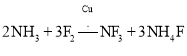
![]() 上述化学方程式中的5种物质所含的化学键类型有 ______
上述化学方程式中的5种物质所含的化学键类型有 ______ ![]() 填序号
填序号![]() 。
。
![]() 离子键
离子键![]() 共价键
共价键![]() 配位键
配位键![]() 金属键
金属键
![]() 与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为 ______ 。
与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为 ______ 。
![]() 的沸点比
的沸点比![]() 的沸点
的沸点![]() 低得多的主要原因是 ______ 。
低得多的主要原因是 ______ 。
![]() 理论上HF、
理论上HF、![]() 和NaCl按6:1:2的物质的量之比恰好反应生成HCl、
和NaCl按6:1:2的物质的量之比恰好反应生成HCl、![]() 和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是 ______ ,配位数为 ______ 。
和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是 ______ ,配位数为 ______ 。
![]() 根据下列五种元素的第一至第四电离能数据
根据下列五种元素的第一至第四电离能数据![]() 单位:
单位:![]()
![]() ,回答下面各题:
,回答下面各题:
元素代号 |
|
|
|
|
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一族的是 ______ 和 ______ 。
②T元素最可能是 ______ (填“s”、“p”、“d”、“ds”等)区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 ______ ,其中心原子的杂化轨道类型为 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是中学化学中常见的四种短周期元素,有关位置及信息如下:
A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F单质是日常生活中用量最大的金属,易被腐蚀或损坏。
| E | A | B | ||
C |
| D |
请回答下列问题:
![]() 元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 ______ 。
元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 ______ 。
![]() 、D的氢化物相互反应,产生白色固体,鉴定该固体需用到的试剂或试纸
、D的氢化物相互反应,产生白色固体,鉴定该固体需用到的试剂或试纸![]() 蒸馏水除外
蒸馏水除外![]() 有 ______ 。
有 ______ 。
![]() 、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为 ______ 。
、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为 ______ 。
![]() 与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: ______ 。
与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: ______ 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
![]() 和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 ______ 。
和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 ______ 。
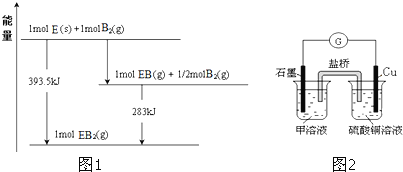
![]() 已知一定量的E单质能在
已知一定量的E单质能在![]()
![]() 中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下
中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下![]() 与
与![]() 反应生成
反应生成![]() 的热化学方程式 ______ 。
的热化学方程式 ______ 。
![]() 若在D与F组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极出现的现象是 ______ ,负极的反应式为 ______ 。
若在D与F组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极出现的现象是 ______ ,负极的反应式为 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 L 3.0 mol·L-1的NH4NO3溶液中含有的![]() 的数目为0.3NA
的数目为0.3NA
B.1.0 L 0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA
C.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.1NA
D.1 L 0.1 mol·L-1的Na2CO3溶液中所含氧原子数目为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com