
科目: 来源: 题型:
【题目】![]() ,向20mL
,向20mL![]() 的
的![]() 溶液中滴加
溶液中滴加![]() 的NaOH溶液
的NaOH溶液![]() 滴定过程中溶液温度保持不变
滴定过程中溶液温度保持不变![]() ,滴定曲线如图1,含磷物种浓度所占分数
,滴定曲线如图1,含磷物种浓度所占分数![]() 随pH变化关系如图2,则下列说法不正确的是
随pH变化关系如图2,则下列说法不正确的是![]()
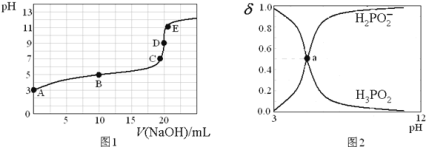
A.![]() 的电离方程式为:
的电离方程式为:![]() ;电离常数
;电离常数![]()
B.B点溶液中存在关系:![]()
C.图2中的a点对应为图1中的B点
D.D点时,溶液中微粒浓度大小关系为:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
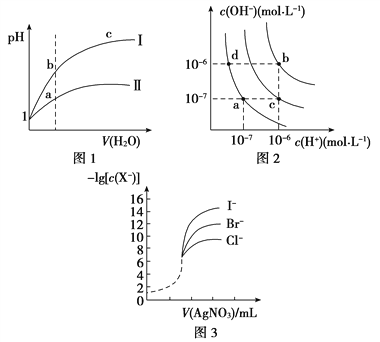
A. 图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图2中纯水仅升高温度,就可以从a点变到c点
C. 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D. 用0.010 0 mol/L硝酸银标准溶液,滴定浓度均为0.100 0 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系不正确的是
A.0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
C.0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合:3c(Na+)=2c(![]() )+2c(
)+2c(![]() )+2c(H2CO3)
)+2c(H2CO3)
D.0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(![]() )+c(
)+c(![]() )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列有关醋酸溶液的叙述中不正确的是
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
C.将pH=a的醋酸稀释为pH=a+1的过程中,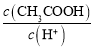 不变
不变
D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

图1 图2 图3 图4
A. 图1表示0.1molMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000 mol·LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol·Lˉ1
C. 图3表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
D. 图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目: 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的![]() 存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是
存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是

A.1个Ca2+周围距离最近且等距离的![]() 数目为4
数目为4
B.该晶体中的阴离子与F2是等电子体
C.6.4 g CaC2晶体中含阴离子0.1 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目: 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
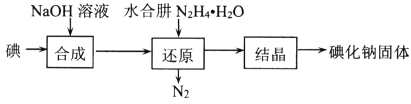
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E是五种常见的物质,其中A是能使带火星木条复燃的气体,B是单质,C是常见的无色液体,且跟日常生活密切相关,D 是淡黄色固体。在一定条件下,A~E五种物质的转化关系如图所示(部分反应条件已略去)。
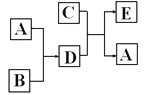
请回答下列问题:
(1)E的化学式___________;
(2)C与B反应的离子方程式_________________________;
(3)D与二氧化碳反应的化学方程式___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
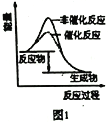


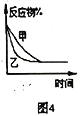
A. 图1表示分别在有、无催化剂的情况下某吸热反应过程中的能量变化
B. 图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线)
C. 图3表示mg冰醋酸加水稀释过程中溶液导电能力的变化,其中醋酸的电离度c>b>a
D. 图4表压强对合成氨反应的影响,乙的压强大
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,现有![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时,各微粒浓度占总微粒浓度之和的分数
平衡时,各微粒浓度占总微粒浓度之和的分数![]() 与pH的关系如图所示。下列说法正确的是
与pH的关系如图所示。下列说法正确的是![]()
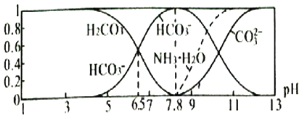
A.当![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
![]()
B.![]() 溶液中存在下列关系:
溶液中存在下列关系: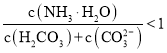
C.向![]() 的上述溶液中逐滴滴加氢氧化钠溶液时,
的上述溶液中逐滴滴加氢氧化钠溶液时,![]() 和
和![]() 浓度逐渐减小
浓度逐渐减小
D.分析可知,常温下水解平衡常数![]() 的数量级为
的数量级为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com