
科目: 来源: 题型:
【题目】下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸厂靠近原料产地比靠近硫酸消费中心更为有利
C.由于2SO2(g)+O2(g)![]() 2SO3(g),所以硫酸生产中常采用高压条件提高SO2的转化率
2SO3(g),所以硫酸生产中常采用高压条件提高SO2的转化率
D.充分利用硫酸厂生产过程中产生的“废热”,可使硫酸厂向外界输出大量的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+。请回答下列问题:
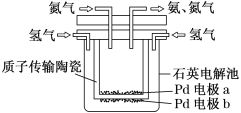
(1)此装置将______能转化为______能。
(2)Pd电极a为_____极(选填“正”、“负”、“阴”或“阳”),电极反应式为___。
(3)当制得6mol氨气时有____mol 质子从____极迁移到____极 (选填“a”或“b”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为____________,若将负极材料改为CH4,写出其负极反应方程式______________。
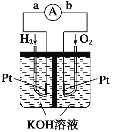
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2常用来漂白织物,其漂白能力是漂白粉的4~5倍NaClO2也是一种重要的杀菌消毒剂。工业上生产NaClO2的一种工艺流程如下图所示:

(1)ClO2发生器中的产品之一是NaHSO4,在该发生器中所发生反应的离子方程式为___________。
(2)反应结束后,向ClO2发生器中通入一定量空气,目的是___________。
(3)吸收器中发生反应的化学方程式为___________。吸收器中要用冷的NaOH溶液和H2O2溶液吸收CO2,原因是___________。
(4)将ClO2通入食盐水中,用情性电极电解,也可以制得NaClO2产品。阳极的电解产物是___________(填化学式),阴极的电极反应式为___________。
(5)相同条件下,1 mol NaClO2与___________gCl2的氧化能力相当。
查看答案和解析>>
科目: 来源: 题型:
【题目】从海水中可提取多种化工原料,下面是工业上对海水成分综合利用的示意图。
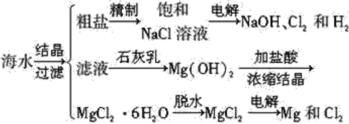
试回答下列问题:
(1)写出用海滩上的贝壳制Ca(OH)2的化学方程式_________________________。
(2)写出电解饱和NaCl溶液的化学方程式___________________________________。
(3)将电解生成的氯气通入石灰乳中可制得漂白粉,写出其反应的化学方程式_______________________。
(4)用海滩上的贝壳制Ca(OH)2而不从异地山中开凿石灰石制取,主要考虑到什么问题?_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答下列问题:
(1)已知H-O键能为463 kJ·mol-1,O=O键能为498 kJ·mol-1。若1 mol氢气完全燃烧生成1 mol气态水放出241 kJ的热量,计算H-H键能为______kJ·mol-1。
(2)已知化学方程式:H2(g)+![]() O2(g) ==H2O(g),该反应的活化能为167.2 kJ·mol-1,其逆反应的活化能为409.0 kJ·mol-1,写出该反应的逆反应的热化学方程式: ________。
O2(g) ==H2O(g),该反应的活化能为167.2 kJ·mol-1,其逆反应的活化能为409.0 kJ·mol-1,写出该反应的逆反应的热化学方程式: ________。
(3)4Al(s)+3O2(g)==2Al2O3(s)ΔH1,4Fe(s)+3O2(g)==2Fe2O3(s)ΔH2,则ΔH1________ΔH2(选填“﹥”、“﹤”或“﹦”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,现有![]() 的
的![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时某种微粒的浓度占各种微粒浓度之和的分数
平衡时某种微粒的浓度占各种微粒浓度之和的分数![]() 与pH的关系如图所示.下列说法正确的是
与pH的关系如图所示.下列说法正确的是![]()
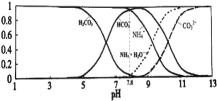
A.当溶液的![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
B.![]() 溶液中存在下列守恒关系:
溶液中存在下列守恒关系:![]()
C.往该溶液中逐滴滴加氢氧化钠时![]() 和
和![]() 浓度逐渐减小
浓度逐渐减小
D.通过分析可知常温下![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是

A. 点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+)
B. 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C. 点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-)
D. 整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
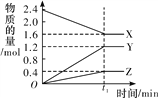
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿
是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿![]() 主要成分
主要成分![]() ,还有
,还有![]() 、
、![]() 、
、![]() 等
等![]() 作脱硫剂,通过如下简化流程既脱除燃煤尾气中的
作脱硫剂,通过如下简化流程既脱除燃煤尾气中的![]() ,又制得
,又制得![]() 反应条件已经省略
反应条件已经省略![]() 。
。
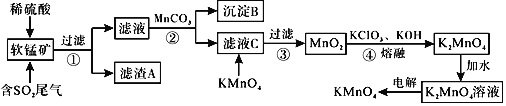
已知:![]() ,
,![]() 回答下列问题:
回答下列问题:
![]() 滤渣A的成分是
滤渣A的成分是![]() 写化学式
写化学式![]() ______。
______。
![]() 析出沉淀B时,首先析出的物质是
析出沉淀B时,首先析出的物质是![]() 写化学式
写化学式![]() ______。
______。
![]() 步骤2中加入
步骤2中加入![]() 的作用为______。
的作用为______。
![]() 滤液C中加入
滤液C中加入![]() 时发生反应的离子方程式是______。
时发生反应的离子方程式是______。
![]() 完成步骤4中反应的化学方程式______
完成步骤4中反应的化学方程式______![]() ______
______![]() ______
______![]() ______
______
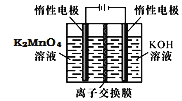
![]() 电解制备
电解制备![]() 的装置如图所示。电解液中最好选择______离子交换膜
的装置如图所示。电解液中最好选择______离子交换膜![]() 填“阳”或“阴”
填“阳”或“阴”![]() 。电解时,阳极的电极反应式为______。
。电解时,阳极的电极反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com