
科目: 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向蛋白质溶液中加入醋酸铅溶液,产生白色沉淀 | 蛋白质发生了盐析 |
B | SO2通入Ba(NO3)2溶液中,产生白色沉淀 | 沉淀为BaSO3 |
C | 向蔗糖中加入适量浓硫酸并搅拌,蔗糖变黑,体积膨胀,并放出刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
D | 分别向等物质的量浓度的苯酚钠溶液和碳酸钠溶液中滴加酚酞,后者红色更深 | 碳酸酸性强于苯酚 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,则这两种烃分别是( )
A. CH4 C5H12 B. C2H6 C4H8 C. CH4 C4H8 D. C2H2 C4H10
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.反应5NH4NO3=2HNO3+4N2↑+9H2O,生成22.4LN2时转移的电子数为3.75NA
B.n(H2SO3)+n(HSO3-)=1mol的NaHSO3溶液中,含有Na+的数目等于NA
C.标准状况下甲烷和氧气的混合气体共22.4L,完全燃烧后产物的分子总数一定为NA
D.10g的D2O中含有的质子数与中子数分别为5NA和4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】氰![]() 的化学性质与卤素
的化学性质与卤素![]() 很相似,化学上称之为拟卤素,其氧化性介于
很相似,化学上称之为拟卤素,其氧化性介于![]() 和
和![]() 之间,下列有关反应方程式不正确的是
之间,下列有关反应方程式不正确的是![]()
![]()
A.![]() 和NaOH溶液反应:
和NaOH溶液反应:![]()
B.![]() 和HCN反应:
和HCN反应: ![]() 浓)=
浓)=![]()
C.向KCN溶液中加入碘水:![]()
D.在NaBr和KCN混合溶液中通入少量![]() :
:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能说明这个结论的是![]()
A.已经制得了IBr、ICl等卤素互化物
B.已经制得了![]() 等碘的氧化物
等碘的氧化物
C.已经制得了![]() 、
、![]() 等含
等含![]() 离子的离子化合物
离子的离子化合物
D.碘单质![]() 在通常情况下为具有金属光泽的紫黑色固体
在通常情况下为具有金属光泽的紫黑色固体
查看答案和解析>>
科目: 来源: 题型:
【题目】金属及其化合物在国民经济发展中起着重要作用。
(1)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜锈的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。该过程中负极的电极反应式为_________。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:
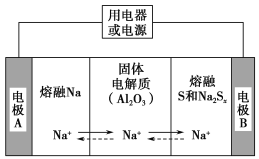
①根据下表数据,请你判断该电池工作的适宜温度应控制在_________。
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2 050 |
沸点/℃ | 892 | 444.6 | 2 980 |
a.100 ℃以下 b.100 ℃~300 ℃
c.300 ℃~350 ℃ d.350 ℃~2 050 ℃
②放电时,电极A为_________极,S发生_________反应。
③放电时,内电路中Na+的移动方向为_________(填写“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx=2Na+Sx(3<x<5),Na所在电极与直流电源_________极相连,阳极的电极反应式________。
(3)某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。
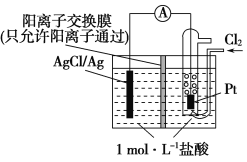
①正极反应为_________。
②当电路中转移0.005 mol e-时,交换膜左侧溶液中约减少_________mol离子。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产和生活等联系紧密。下列说法正确的是( )
A.“白色污染”泛指聚乙烯、聚丙烯等塑料污染,它们的分子内部都含有双键
B.聚丙烯酸酯类涂料(![]() )是目前流行的墙面涂料之一,它是通过缩聚反应形成的
)是目前流行的墙面涂料之一,它是通过缩聚反应形成的
C.制作手术缝合线或人造器官材料可以是聚乳酸或聚氨酯等
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都属于新型有机高分子材料
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物A经李比希法测得其中含C 72.0%、 H 6.67%,其余为氧,质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法:
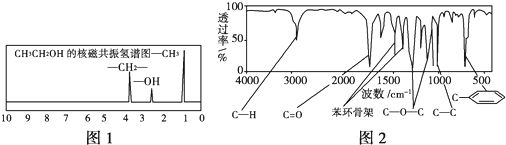
方法一:核磁共振仪可以测定有机物分子里不同化学环境的氢原子及其相对数量。如乙醇(CH3CH2OH)的核磁共振氢谱有3个峰,其面积之比为3:2:1,如图1所示,现测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3;
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图2所示。
已知:A分子中只含一个苯环,且苯环上只有一个取代基,试回答下列问题:
(1)A的分子式为:_______________
(2)A的结构简式为(写出两种): ___________________、________________ 。
(3)A的芳香类同分异构体有多种,请按要求回答下列问题:
①分子中不含甲基的芳香酸: ___________________________;
②属于酚类且苯环上只有两个取代基的芳香醛共有________种。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K1、K2、K3之间的关系为K3=____________。
(2)T℃时,2NO(g)+Cl2(g)![]() 2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | υ/mol·L-1· s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=__________;k=___________(注明单位)。
(3)在2 L的恒容密闭容器中充入4 mol NO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图I。

① 温度为T1时,能作为该反应达到平衡的标志的有__________。
a.气体体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.υ(ClNO)=υ(NO) f.NO与ClNO的物质的量比值保持不变
② 反应开始到10min时,Cl2的平均反应速率υ(Cl2)=_______________。
③ 温度为T2时,10 min时反应已经达到平衡,该反应的平衡常数K=____________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随![]() 的变化如图II,则A、B、C三个状态中,NO的转化率最小的是____点,当
的变化如图II,则A、B、C三个状态中,NO的转化率最小的是____点,当![]() 时,达到平衡状态时ClNO的体积分数φ可能是D、E、F三点中的_____点。
时,达到平衡状态时ClNO的体积分数φ可能是D、E、F三点中的_____点。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述正确的是( )
4NO+6H2O(g),下列叙述正确的是( )
A.达到平衡状态,2 v正(NH3)= 3v逆(H2O)
B.单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.反应达到平衡时,反应物的转化率一定小于100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com