
科目: 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的还原产物是______;
(2)该反应的平衡常数表达式为K=____________;
(3)若知上述反应为放热反应,则其反应热△H______0(填“>”、“<”或“=”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);若已知CO生成速率为![]() (CO)=18molL﹣1min﹣1,则N2消耗速率为
(CO)=18molL﹣1min﹣1,则N2消耗速率为![]() (N2)=_________;
(N2)=_________;
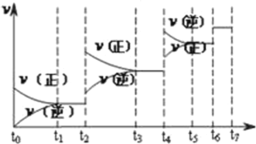
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率![]() 与时间t的关系如图,图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是__________。
与时间t的关系如图,图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.现有下列物质①100 ℃纯水②25 ℃ 0.1 mol/L HCl溶液③25 ℃ 0.1 mol/L KOH溶液④25 ℃ 0.1 mol/L Ba(OH)2溶液。
(1)这些物质与25 ℃纯水相比,能促进水电离的是________(填序号,下同),能抑制水的电离的是________,水电离的c(OH-)等于溶液中c(OH-)的是________,水电离的c(H+)等于溶液中c(H+)的是________。
(2)②和③溶液中水的电离度相等,进而可推出的结论是:同一温度下,___________时,水的电离度相等。
II.今有①盐酸②醋酸③硫酸三种稀溶液,用序号回答下列问题。
(1)若三种酸的物质的量浓度相等,三种溶液中的c(H+)大小关系为______
(2)若三种溶液的c(H+)相等,三种酸的物质的量浓度大小关系为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。
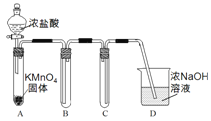
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是___________、_______________。
(2)制得的氯气中加入适量水,得到饱和氯水,饱和氯水中含氯元素的微粒有____________(写出全部微粒)。
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
①滤液漂白性增强的原因是________________(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HC1O的方程式是___________________。
Ⅱ. ClO3—、Cl—和H+反应的探究
(4)KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的_______________________。
②烧杯3取用硫酸的体积应为______________mL。
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)根据官能团可以对有机物进行分类、鉴别和除杂。
①下列有机物属于烃的是___(填字母)。
a.乙炔 b.乙醇 c.乙酸
②区分甲苯和苯,可用的试剂是___(填字母)。
a.FeCl3溶液 b.酸性KMnO4溶液 c.溴水
③除去乙酸乙酯中的乙酸,可用的试剂是___(填字母)。
a.NaOH溶液 b.NaCl溶液 c.饱和Na2CO3溶液
(2)异丙苯是一种重要的有机化工原料。异丙苯的结构简式为![]() 。
。
①异丙苯中最多有___个碳原子共平面,其核磁共振氢谱上有___个峰。
②异丙苯氧化后可制取分子式为C6H6O的芳香族化合物,该化合物的结构简式是___。
③异丙苯制备对溴异丙苯的化学方程式为___。
(3)化合物III是一种合成医药的中间体,其合成路线如下:
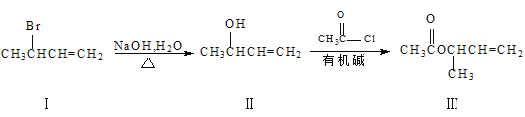
①III中所含官能团的名称是___和___。
②该合成路线中第二步反应属于___反应(填反应类型)。
③I、Ⅱ、Ⅲ三种物质中,与浓硫酸共热能得到CH2=CHCH=CH2的是___(填序号)。物质Ⅱ在Cu作催化剂及加热条件下与O2反应可得产物为___。
④Ⅲ的一种同分异构体X能发生银镜反应,不能发生水解反应,分子中有3种不同化学环境的氢。X的结构简式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成填空
(1)计算25 ℃时下列溶液的pH:
①1 mL pH=2的H2SO4加水稀释至100 mL,pH=________;
②0.001 mol/L的盐酸,pH=________;
③0.01 mol/L的NaOH溶液,pH=________;
④0.015 mol/L的硫酸与0.01 mol/L的NaOH等体积混合,混合溶液的pH=________。
(2)H2S溶于水的电离方程式为_______________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知298 K时,合成氨反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
A. 一定小于92.0 kJ B. 一定大于92.0 kJ
C. 一定等于92.0 kJ D. 无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)材料是人类赖以生存的物质基础。
①制造水泥、玻璃都要用到的原料是___(填字母)。
a.石灰石 b.纯碱 c.黏土
②不锈钢丝与棉纤维可织成一种防辐射布料。这种布料属于___(填字母)。
a.合金材料 b.复合材料 c.陶瓷材料
③橡胶可用于制造轮胎,天然橡胶通过___(填字母)措施可增大强度和弹性。
a.硝化 b.氧化 c.硫化
(2)环境保护功在当代、利在千秋。
①燃煤中加入碳酸钙,可减少SO2的排放。表示该反应原理的化学方程式为___。
②治理废水中的重金属污染物可用沉淀法。往含铬(Cr3+)废水中加入石灰乳使Cr3+转变为___(填化学式)沉淀而除去。
③将CO2和H2按物质的量1∶4混合,在Ru/TiO2作催化剂、加热条件下反应可获得CH4。写出该反应的化学方程式:___。
(3)合理选择饮食,有益身体健康。某同学在食堂的午餐是:米饭、红烧肉、西红柿炒鸡蛋和一只苹果。
①其中主要为人体提供能量的食物是___。该食物中的主要成分在人体内完全水解的化学方程式为___。
②西红柿中富含维生素C,西红柿生吃比炒熟后吃维生素C的利用率高,原因是___。用淀粉溶液和碘水检验维生素C的还原性,有关实验操作和现象是___。
③苹果中含有一定量的铁元素,人体缺铁会导致的疾病是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各物质常温下发生水解,对应的离子方程式正确的是
A.Na2CO3:CO32-+2H2O![]() H2O+CO2↑+2OH-
H2O+CO2↑+2OH-
B.NH4Cl:NH4++H2O![]() NH3·H2O+OH-
NH3·H2O+OH-
C.CuSO4:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
D.NaF:F-+H2O=HF+OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室从含碘废液(含有H2O 、CCl4、I2、I-等)中回收碘,操作过程如下:
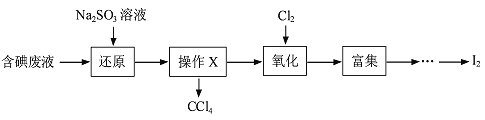
(1)向废液中加入Na2SO3溶液,发生“还原”反应的离子方程式为____________。
(2)“氧化”操作在三颈烧瓶中进行(如图一),将溶液用盐酸调至pH约为2,缓慢通入Cl2。实验用水浴控制在40℃左右的较低温度下进行的原因是_______。
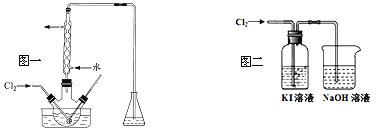
(3)某研究小组用图二装置对Cl2与KI溶液的反应进行探究,发现通入Cl2一段时间后,KI溶液变为黄色,继续通入Cl2,则溶液黄色变浅,最后变为无色。研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
假设一:没有I2形态;假设二:没有I-形态;假设三:有IO3-形态。
①请设计实验证明假设一成立(试剂自选)。
实验操作 | 预期现象 | 结论 |
___________________ | 假设一成立 |
②若假设三成立,请写出生成IO3-的离子方程式__________________________________。
(4)该研究小组还进行了对加碘盐中KIO3含量测定的如下实验:
①准确称取加碘盐m g于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成250.00mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉试液,用c molL-1Na2S2O3标准液滴定至终点,重复3次,测得平均值为V mL。
已知:IO3-+ 5I-+6H+ =3H2O+3I2,I2 +2S2O32-=2I-+S4O62-。测定时,判断达到滴定终点的现象为___________。由测定数据可求得该样品中含KIO3的质量分数为___________(用含m、c、V的代数式表示,Mr(KIO3)=214 )。
②在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.某学习小组做Na2O2与H2O反应的实验,发现一些有趣的现象:
①取适量Na2O2固体用脱脂棉包好放在石棉网上,然后向脱脂棉上滴加3-4滴水,结果脱脂棉剧烈燃烧。
②取适量Na2O2固体置于试管中,加水使其充分反应至不再产生气体为止,滴入几滴酚酞试液,溶液先变红后褪色。回答有关问题。
(1)写出Na2O2的电子式_______________________。
(2)已知Na2O2可看作二元弱酸H2O2对应的盐,其第一步水解完全进行。写出其第一步水解的离子方程式为___________________________________。
(3)由①实验现象所得出的有关结论是:a.有氧气生成;b.___________________。
(4)Na2O2与H2O反应的离子方程式____________________________________。
II.为探究Na2O2与H2O反应的机理,他们在老师的指导下设计了下图所示装置。连接好装置,打开K1、K2,通过注射器注入适量蒸馏水,充分反应后用气球鼓气,Na2S溶液变浑浊,酸性KMnO4溶液褪色。分别取A、C中溶液滴入几滴酚酞,开始都变红,以后A中溶液很快褪色,C中溶液缓慢褪色。另取A、C中溶液分别加入少量二氧化锰,充分振荡,发现均反应剧烈、产生大量气泡,把带火星的木条伸入试管,木条复燃,向反应后的溶液中滴入几滴酚酞试液,溶液变红不褪色。

(5)A中冰盐和C中热水的作用分别是__________________,___________________。
(6)用化学方程式表示Na2S变浑浊的原因___________________________________。
(7)用离子方程式表示KMnO4溶液褪色的原因(MnO4-在酸性条件下被还原成Mn2+)__________________________________________。
(8)Na2O2与H2O反应的机理是(用化学方程式表示)第一步_____________________,第二步_______________________________。
(9)若向Na2O2中滴加适量的稀盐酸,也能产生同样的气体,请写出该反应的化学方程式___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com