
科目: 来源: 题型:
【题目】下面四种变化中,有一种变化与其他三种变化类型不同的是( )
A.CH3CH2OH + CH3COOH ![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
B.CH3CH2Br+NaOH ![]() CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
C.2CH3CH2OH![]() CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D.CH3CH2OH + HBr→CH3CH2Br + H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)为紫黑色粉末,是一种新型高效消毒剂。K2FeO4易溶于水,微溶于浓KOH溶液,在0~5 ℃的强碱性溶液中较稳定。一般制备方法是先用Cl2与KOH溶液在20 ℃以下反应生成KClO(在较高温度下则生成KClO3),KClO再与KOH、Fe(NO3)3溶液反应即可制得K2FeO4。实验装置如图所示:

回答下列问题:
(1) 制备KClO。
①装置B的作用_______。
②装置C中三颈烧瓶置于冰水浴中的目的是________。
(2) 制备K2FeO4。
①装置C中得到足量KClO后,将三颈烧瓶上的导管取下,加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度,搅拌,当溶液变为紫红色,该反应的离子方程式为______。
②向装置C中加入饱和KOH溶液,析出紫黑色晶体,过滤。
(3) 测定K2FeO4纯度。
测定制备的K2FeO4的纯度可用滴定法,滴定时有关反应的离子方程式为:a. ![]() +
+ ![]() +2H2O=
+2H2O= ![]() +Fe(OH)3↓+OH;b.2
+Fe(OH)3↓+OH;b.2![]() +2H+=
+2H+= ![]() +H2O;c.
+H2O;c. ![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O。称取2.0g 制备的K2FeO4样品溶于适量KOH 溶液中,加入足量的KCrO2,充分反应后过滤,滤液在250 mL 容量瓶中定容。取25.00 mL 加入稀硫酸酸化,用0.10 mol·L-1的(NH4)2Fe(SO4)2 标准溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00 mL,则该K2FeO4 样品的纯度为______。
+6Fe2++14H+=2Cr3++6Fe3++7H2O。称取2.0g 制备的K2FeO4样品溶于适量KOH 溶液中,加入足量的KCrO2,充分反应后过滤,滤液在250 mL 容量瓶中定容。取25.00 mL 加入稀硫酸酸化,用0.10 mol·L-1的(NH4)2Fe(SO4)2 标准溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00 mL,则该K2FeO4 样品的纯度为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】Y(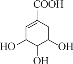 )是由中草药五倍子制备而成。
)是由中草药五倍子制备而成。
(1) Y属于_____填“无机化合物”或“有机化合物”)。
(2) Y中含氧官能团有羧基和_____(填名称)。
(3) 向Y溶液中滴入溴水,溴水褪色,说明Y中含有_____。
(4) Y具有还原性。向Y溶液中滴入几滴酸性KMnO4稀溶液,实验现象为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为 -69℃和58℃,写出该反应的热化学方程式___________。
(2)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9∶1,其电子式为______________。
(3)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价的含氧酸盐,消耗1.0L 2.2molL-1NaOH溶液和1.0molO2,则两种气体中相对分子质量小的气体物质的量为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯和碘是ⅦA元素,回答下列问题:
(1)I3-中心原子的价层电子对数为_______ ,沸点ICl____Cl2(填大于,小于,等于)。
(2)已知CsICl2受热分解,该分解的化学方程式是___________________。
(3)已知高碘酸的结构如图1所示,1mol高碘酸中含有__________mol![]() 键。
键。
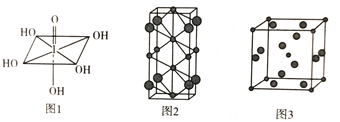
(4)Na和Cl两种元素可以形成不同类型的晶体,如图2和图3(大球为氯原子,小球为钠原子),图2化学式为_____________;图3中Na+的配位数为___________。
(5)若图3晶胞的边长为a cm,则晶体的密度![]() =____(NA表示阿伏加德罗常数的值)。
=____(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8kJ·mol-1、283.0kJ·mol-1和726.5kJ·mol-1。回答下列问题:
(1)用太阳能分解100g水消耗的能量是_______kJ。
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为____________。
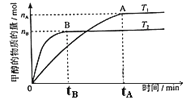
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);下列说法正确的是________(填序号)。
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为___________。
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为_____________。理想状态下,该燃料电池消耗1molCH3OH所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为___________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
查看答案和解析>>
科目: 来源: 题型:
【题目】“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O = 2Mg (OH)2。下列关于该电池的说法正确的是

A.电池工作时,镁片作为负极,发生还原反应
B.电池工作时,电子通过电解质溶液由镁电极流向活性炭电极
C.电池工作时,活性炭上电极反应为:O2 + 4e- + 2H2O == 4OH-
D.电池工作时,活性炭电极表面产生气泡
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】意大利科学家获得了极具研究价值的![]() 分子结构如图所示
分子结构如图所示![]() ,以下有关物质结构的说法正确的是( )
,以下有关物质结构的说法正确的是( )
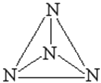
A.N均是以![]() 杂化,
杂化,![]() 均为
均为![]() 键
键
B.N的电负性大于O,所以![]() 的沸点低于
的沸点低于![]()
C.![]() 为原子晶体,每个N的配位数为3
为原子晶体,每个N的配位数为3
D.N原子核外有5个未成对电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于晶体说法的正确组合是

①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com