
科目: 来源: 题型:
【题目】俄罗斯用“质子![]() ”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知下图:
”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知下图:
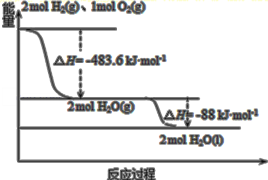
下列说法正确的是
A.2mol![]() 与1mol
与1mol![]() 所具有的总能量比
所具有的总能量比![]() 所具有的总能量低
所具有的总能量低
B.氢气的标准燃烧热为H=-285.8kJ/mol
C.火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)=2H2O(g) H=-483.6kJ/mol
D.![]() 变成
变成![]() 的过程中,断键吸收的能量小于成键放出的能量
的过程中,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列六种物质:![]() 、
、![]() 、CaO、MgO、
、CaO、MgO、![]() 、
、![]() .
.
(1)按照不同的分类标准,它们中有一种物质与其他物质有明显的不同,请找出这种物质,并写出分类的依据.① ______②______.
(2)从反应中有无离子参加,可以将化学反应分为离子反应和非离子反应,![]() 与水反应的离子方程式是______.
与水反应的离子方程式是______.
(3)从上述氧化物中分别找出两种能相互反应的物质,写出一个非氧化还原反应的方程式和一个氧化还原反应的方程式,______.
(4)虽然分类的方法不同,但离子反应和氧化还原反应之间存在着一定的关系,请用简单的图示方法表示二者之间的关系:______.
查看答案和解析>>
科目: 来源: 题型:
【题目】由H、C、N、O、S等元素形成多种化合物在生产生活中有着重要应用。
I.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g)△H1=-36kJ·mol-1
2CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,年生产lmolCO,转移电子的数目为______________________。
(2)甲醇催化脱氢可制得重要的化工产品一甲醛,制备过程中能量的转化关系如图所示。
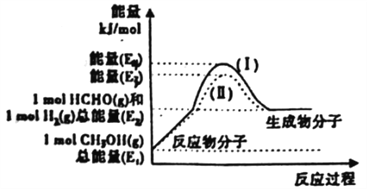
①写出上述反应的热化学方程式________________________________。
②反应热大小比较:过程I________过程II(填“大于”、“小于”或“等于”)。
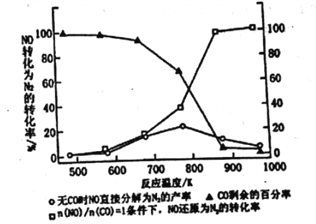
II.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领城的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,删得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低。其可能的原因为_____________________________________,
在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_______K左右。
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式_________________________________________;
②若T1<T2
③上述反应T1℃时达到化学平衡后再通入0.1mol NO气体,则达到新化学平衡时NO的转化率为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验测定某硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)样品纯度的过程为:称取1.5000 g样品,配成100 mL溶液。取0.01mol ·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量的KI。充分反应后,以淀粉作指示剂,用硫代硫酸钠溶液滴定产生的I2,终点时消耗溶液20.00 mL。样品中所含硫代硫酸钠晶体的质量分数为(杂质不参与反应,反应过程中的物质转化关系为K2Cr2O7![]() I2
I2![]() S4O
S4O![]() )
)
A.99.20%B.96.72%C.94.24%D.91.76%
查看答案和解析>>
科目: 来源: 题型:
【题目】已知磷酸分子(![]() )中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
)中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
A. H3 PO2属于三元酸 B. H3 PO2的结构式为
C. NaH2PO2属于酸式盐 D. NaH2PO2溶液可能呈酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应叙述相符的是
A.如图:常温下,0.1 mol ·L-1盐酸稀释时pH随加入水的体积变化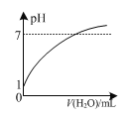
B.如图:铅蓄电池放电时,正极附近溶液的pH随时间的变化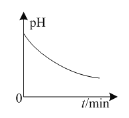
C.如图:不同压强下,可逆反应A(g)+B(g)![]() C(g)+D(s)中A的浓度随时间的变化
C(g)+D(s)中A的浓度随时间的变化
D.如图:镁条放入足量2 mol ·L-1盐酸中,生成氢气速率随时间的变化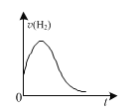
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.Mg投入稀HNO3中:Mg+2H+=Mg2++H2↑
B.MnO2与浓盐酸混合加热制Cl2:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.向稀H2SO4和H2O2的混合液中加入Cu粉:2H++H2O2+Cu=Cu2++2H2O
D.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO![]() +2H2O+4NH
+2H2O+4NH![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,0.1mol·L-1某一元酸HA溶液中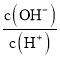 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10mol·L-1
B.溶液中c(H+)+c(A-)=0.1mol·L-1
C.常温下将HA稀释10倍,氢离子浓度变为原来的十分之一
D.上述溶液加NaA晶体,溶液的c(OH-)增大
查看答案和解析>>
科目: 来源: 题型:
【题目】图中A为淡黄色固体,B的阳离子与A相同(其他物质均略去).
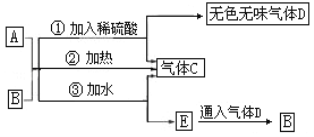
根据以上关系,回答下列问题:
(1)A的电子式为__________.
(2)A投入FeCl2溶液中的反应为_______________(请用一个化学方程式表示)
(3)若A、B按物质的量之比1:1.5混合在密闭容器中加热充分反应后,排出气体,则剩余的固体为_____________________________(写化学式)
(4)氢能被视为21世纪最具发展潜力的清洁能源,试回答下列问题:
①与化石燃料相比,氢气作为燃料的优点是__________________(答两点)。
②施莱辛(Sehlesinger)等人提出可用NaBH4与水反应制氢气,写出NaBH4与水反应的化学方程式____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由含碘废水制取碘酸钾的一种工艺如下:
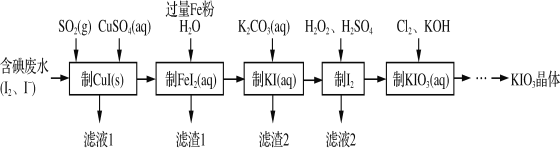
⑴ 写出KIO3在日常生活中的一个重要应用________________________。
⑵ 检验“含碘废水”中是否含有单质I2的常用试剂是________(写试剂名称)。
⑶ 通入SO2的目的是将I2还原为I-,该反应的离子方程式为______________________。
⑷ 工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制________”。
⑸ “制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。
为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于______。
⑹ “制KIO3溶液”反应的离子方程式为__________________。

⑺ KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com