
科目: 来源: 题型:
【题目】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义,该反应为:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时达到平衡,测得CO的浓度为0.5mol/L。
2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时达到平衡,测得CO的浓度为0.5mol/L。
回答下列问题:
(1)0~5min时间内用H2表示的化学反应速率为___mol/(L·min)。
(2)达平衡时CH4的物质的量分数为___,CO2的转化率是___。
(3)反应前后混合气体的压强之比为___。
(4)为了加快反应速率,可采取什么措施___(写两条)。
(5)下表中的数据是破坏1mol物质中的化学键所消耗的能量:
物质 | CH4 | CO2 | CO | H2 |
能量/kJ | 1660 | 1490 | 1072 | 436 |
该催化重整反应中反应物的总能量___生成物的总能量(填“大于”或“小于”)。
(6)下列能表示该反应已经达到化学平衡状态的是___。
A.v逆(CH4)=2v正(CO)
B.CO2的浓度保持恒定
C.混合气体平均相对分子质量不变
D.混合气体密度保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA溶液所得滴定曲线如图。下列说法不正确的是

A.HA的电离平衡常数Ka=10-5
B.点①所示的溶液中:2c(Na+)=c(A-)+c(HA)
C.点③所示的溶液中:c(HA)>c(OH-)-c(H+)
D.点④所示的溶液中:2c(OH-)-2c(H+)=c(A-)+3c(HA)
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学-选修3:物质结构与性质]固体电解质有广泛的用途。研究发现,晶体中有特殊结构为离子(如Li+)提供快速迁移的通道或者有“点缺陷”。都能使其具有导电潜力,比如:图(a)所示的锂超离子导体Li3SBF4和图(b)所示的有“点缺陷”的NaCl。
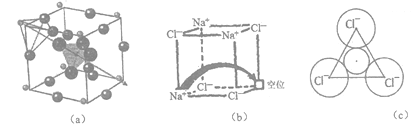
根据所学知识回答下列问题:
(1)在变化“Cl+e-→Cl-”过程中,所得电子填充在基态 Cl的________能级,此过程会________ (填“吸收”或“释放”)能量。
(2)BF4-中B的杂化形式为________________,其等电子体为___________(任写一种)。与其VSEPR模型相同,且有l对孤电子对的相对分子质量最小的分子是___________。
(3)图(a)所示晶胞中Li+位于_____位置;若将晶体中BF4-换成F-,导电能力会明显降低,原因是______________________________。
(4)图(6)中,若缺陷处填充了Na+,则它__________(填“是”或“不是”) NaCl的晶胞,在NaCl晶体中,Na+填充在Cl-堆积而成的__________面体空隙中。
(5)有人认为:高温下有“点缺陷”的NaCl晶伙导电性增照是由于Na+迁移到另一空位而造成。其中Na+经过一个由3个Cl-组成的最小三角形窗孔(如图c所示)。已知晶胞参数a=564 pm,r(Na+)=116pm, r(Cl-)=167 pm,通过计算三角形窗孔半径,判断该认识是否正确。__________。(已知:![]() ≈1.414,
≈1.414,![]() ≈1.732)
≈1.732)
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学-选修3:物质结构与性质]固体电解质有广泛的用途。研究发现,晶体中有特殊结构为离子(如Li+)提供快速迁移的通道或者有“点缺陷”。都能使其具有导电潜力,比如:图(a)所示的锂超离子导体Li3SBF4和图(b)所示的有“点缺陷”的NaCl。
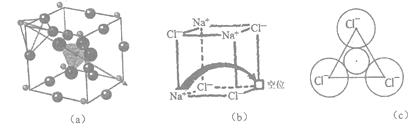
根据所学知识回答下列问题:
(1)在变化“Cl+e-→Cl-”过程中,所得电子填充在基态 Cl的________能级,此过程会________ (填“吸收”或“释放”)能量。
(2)BF4-中B的杂化形式为________________,其等电子体为___________(任写一种)。与其VSEPR模型相同,且有l对孤电子对的相对分子质量最小的分子是___________。
(3)图(a)所示晶胞中Li+位于_____位置;若将晶体中BF4-换成F-,导电能力会明显降低,原因是______________________________。
(4)图(6)中,若缺陷处填充了Na+,则它__________(填“是”或“不是”) NaCl的晶胞,在NaCl晶体中,Na+填充在Cl-堆积而成的__________面体空隙中。
(5)有人认为:高温下有“点缺陷”的NaCl晶伙导电性增照是由于Na+迁移到另一空位而造成。其中Na+经过一个由3个Cl-组成的最小三角形窗孔(如图c所示)。已知晶胞参数a=564 pm,r(Na+)=116pm, r(Cl-)=167 pm,通过计算三角形窗孔半径,判断该认识是否正确。__________。(已知:![]() ≈1.414,
≈1.414,![]() ≈1.732)
≈1.732)
查看答案和解析>>
科目: 来源: 题型:
【题目】牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列溶解平衡:Ca5(PO4)3OH(s)![]() 5Ca2+(aq)+3 PO43—(aq)+OH(aq)。试回答问题:
5Ca2+(aq)+3 PO43—(aq)+OH(aq)。试回答问题:
(1)小孩吃糖后,如果不及时刷牙或漱口,细菌和酶就会作用于糖,在口腔内产生有机羧酸,久而久之,牙齿就会受到腐蚀,其原因是___________。
(2)已知Ca5 (PO4)3F(s)的溶解度比上述矿化产物Ca5(PO4)3OH的溶解度更小,质地更坚硬。当牙膏中配有氟化物添加剂后能防止龋齿,其原因是(用离子方程式和简要文字说明)___________。
(3)根据以上原理,请你提出一种其他促进矿化的方法:_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 时,浓度均为
时,浓度均为![]() 的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是
的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是![]()
A.BOH溶于水,其电离方程式是![]()
B.在![]()
![]() 溶液中,
溶液中,![]()
C.若一定量的上述两溶液混合后![]() ,则
,则![]()
D.若将![]()
![]() 溶液稀释至
溶液稀释至![]()
![]() ,则溶液的
,则溶液的![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是有关物质的Ksp:
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
Ksp(单位省略) | 2.8×10-9 | 6.8×10-6 | 4.7×10-6 | 5.6×10-12 |
回答下列问题:
(1)___(填“能”或“不能”)直接把贝壳研磨成粉末撒入海水中,使Mg2+转化为MgCO3沉淀,原因是_______。
(2)实际生产中是把Mg2+转化为Mg(OH)2沉淀,而不是转化为MgCO3沉淀,原因是______,请你推测应将贝壳进行怎样的加工处理_____。
(3)某同学在实验室条件下模拟该生产过程,在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他_____(填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是__________。
(4)要制得无水MgCl2,过滤出Mg(OH)2沉淀后,用试剂_____(填化学式)将其溶解,选择该试剂的理由是__________。
(5)将得到的氯化镁溶液在浓缩池中制得MgCl2·6H2O。然后将MgCl2·6H2O转移到干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O,才能得到无水MgCl2,原因是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中。纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是
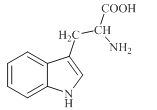
A.色氨酸的分子式为C11H12N2O2
B.色氨酸能发生取代、加成、酯化、中和反应
C.色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐
D.将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三种二肽
查看答案和解析>>
科目: 来源: 题型:
【题目】有些特殊的钢中含有Fe、C、Mn、V等元素,其中Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如下表:
元素 | Mn | Fe | |
电离能(kJ/mol) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列问题:
(1)Mn元素基态原子的价电子排布图为________。比较锰和铁两元素的电离能I2和I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是:________________。
(2)钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。分子中采取sp2杂化的原子有_________,1mol分子中含有配位键的数目是_____。
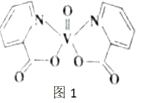
(3)铁元素广泛应用,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成黄血盐,其配离子结构如图![]() 离子所带电荷未标出
离子所带电荷未标出![]() 。
。
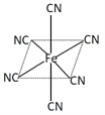
①已知CN-与N2结构相似,CN-的电子式是___________。
②化合物Fe(CO)5熔点为253K,沸点为376K,其固体属于____晶体。
③写出沉淀溶解的化学方程式_______________________________。
④图2的甲是Fe的一种晶胞,晶胞中Fe的堆积方式为___________,己知该晶体的密度为ρg/cm3用NA表示阿伏加德罗常数的值,则该晶胞的边长为___________cm。
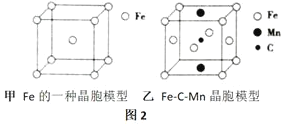
⑤图2的乙是Fe-C-Mn合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe的个数为____________,该合金的化学式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A~G是短周期主族元素,原子序数依次增大,部分元素的部分信息如下表所示:
A | B | C | D | E | F | |
原子半径/nm | 0.077 | 0.075 | 0.074 | 0.099 | ||
主要 化合价 | +4 -4 | +5 -3 | -2 | +6 -2 | ||
其他 | 一种同位素原子无中子 | 所有有机物中一定含有的元素 | 简单氢化物常用作制冷剂 | 短周期主族元素中原子半径最大 |
回答下列问题(用相应化学用语):
(1)G在周期表中的位置是___,F的简单离子结构示意图是___。
(2)由A、C、G三种元素形成的原子个数比为4:1:1的化合物的电子式为___,该化合物所含的化学键有___。(填化学键类型)
(3)D、E、F、G简单离子半径由小到大顺序___。
(4)用电子式表示BD2的形成过程___。
(5)C、D、F的简单氢化物中沸点由高到低的顺序是___。
(6)写出E2D2和A2D反应的化学方程式___,该反应每消耗1molE2D2电子转移数目为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com