
科目: 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) △H=-285.8 kJ·mol-1
O2(g)=H2O(l) △H=-285.8 kJ·mol-1
②H2O(g)=H2(g)+![]() O2(g) △H=+241.8 kJ·mol-1
O2(g) △H=+241.8 kJ·mol-1
③C(s)+![]() O2(g)= CO(g) △H=-110.5 kJ·mol-1
O2(g)= CO(g) △H=-110.5 kJ·mol-1
④CO2(g)=C(s)+O2(g) △H=+393.5 kJ·mol-1
回答下列问题:
(1)上述反应中属于放热反应的是_________________________。
(2)H2的燃烧热为____________,C的燃烧热为_____________。
(3)CO燃烧时的热化学反应方程式为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是

A.W、Y对应的简单氢化物的沸点前者高
B.阴离子的还原性:W2->Q-
C.离子半径:Y2->Z3+
D.元素的非金属性:Y>W
查看答案和解析>>
科目: 来源: 题型:
【题目】锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:

(1)第②步反应得到的沉淀X的化学式为____________________。
(2)第③步反应的离子方程式是___________________________。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有_____________________。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:____________________、_______________________________________。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1g,第③步反应中加入20.0mL3.0mol.![]() 的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有________________gNa2CO3参加了反应。
的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有________________gNa2CO3参加了反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:

(1)上表的6种酸进行比较,酸性最弱的是:_____;HCOO-、S2-、HSO3-三种离子中,最难结合H+的是__________。
(2)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是:_________。
(3)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:___。
(4)下列离子方程式书写正确的是________。
A.HNO2+HS-=NO2-+H2S↑
B.2HCOOH+SO32-=2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32-
D.H2SO3+SO32-=2HSO3-
E.H2C2O4+NO2-=HC2O4-+HNO2
(5)将少量的SO2通入Na2C2O4溶液,写出离子方程式___。
(6)已知HX为一元弱酸。HX的电离常数为5.5×10﹣8。某混合溶液中含有4molNaX、2molNa2CO3和1molNaHCO3。往溶液中通入3molCO2气体,充分反应后,气体全部被吸收,计算某些物质的量:Na2CO3______、NaHCO3______。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用I2O5可消除CO污染或定量测定CO,反应为:
5CO(g)+I2O5(s)5CO2(g)+I2(s);△H1
(1)已知:2CO(g)+O2(g)2CO2(g);△H2
2I2(s)+5O2(g)2I2O5(s);△H3
则△H1=____________________(用含△H2和△H3的代数式表示).
(2)不同温度下,向装有足量I2O5固体的1L恒容密闭容器中通入1molCO,测得CO2的浓度c(CO2)随时间t变化曲线如图.请回答:

①从反应开始至a点时的反应速率为v(CO)=______________,b点时化学平衡常数Kb=______.
②d点时,温度不变,若将容器体积压缩至原来的一半,请在图中补充画出CO2体积分数的变化曲线_________.
③下列说法正确的是_____.(填字母序号)
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的平均相对分子质量相等
C.增加I2O5的投料量有利于提高CO的转化率
D.b点和d点的化学平衡常数:Kb<Kd.
查看答案和解析>>
科目: 来源: 题型:
【题目】下图三条曲线表示不同温度下水的离子积常数,下列说法不正确的是
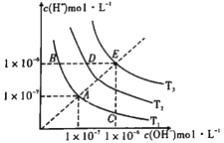
A. 图中温度:T3>T2>T1
B. 图中pH关系是:pH(B)=pH(D)=pH(E)
C. 图中五点Kw间的关系:E>D>A=B=C
D. C点可能是显酸性的盐溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示常温下,0.100 mol/L NaOH溶液滴定20.00 mL、0.100 mol/L HC1溶液所得到的滴定曲线。
C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<b
D.图Ⅳ表示反应4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
查看答案和解析>>
科目: 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一密闭容器中进行,下列说法正确是
CO(g)+H2(g)在一密闭容器中进行,下列说法正确是
A.保持容器体积不变,增加C的物质的量,反应速率增大
B.保持容器体积不变,充入N2容器内气体压强增大,化学反应速率增大
C.保持压强不变,充入N2容器内气体压强不变,化学反应速率减小
D.保持容器体积不变,随着反应进行气体物质的量增多,压强增大,反应速率逐渐加快
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系![]() 其它产物已略去
其它产物已略去![]() 。
。
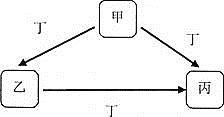
![]() 若丁为KOH溶液,写出乙的一种用途________,甲
若丁为KOH溶液,写出乙的一种用途________,甲![]() 丙的离子方程式为________。
丙的离子方程式为________。
![]() 若丁为Fe,写出向丙溶液中加入NaOH溶液的化学方程式:________;该实验现象为________。
若丁为Fe,写出向丙溶液中加入NaOH溶液的化学方程式:________;该实验现象为________。
![]() 若甲、乙、丙均为焰色反应呈黄色的化合物,则丁可能为________。
若甲、乙、丙均为焰色反应呈黄色的化合物,则丁可能为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z三种元素的原子序数依次减小且三者原子序数之和为16,其常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是

A. X元素位于ⅥA族
B. 1 mol Y和3 mol Z在一定条件下充分反应生成2 mol C
C. A和C在一定条件下能发生氧化还原反应
D. C和X一定条件下能反应生成A和B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com