
科目: 来源: 题型:
【题目】X、Y、Z、W均为短周期主族元素,X、Y、Z原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。W的最外层电子数等于X的核外电子总数,且W单质常温下为固体。请回答下列问题:
(1)Z在周期表中的位置为______________。
(2)Y元素形成的离子的结构示意图为____________。
(3)X、Y、Z三种元素对应的原子半径大小关系为____________(填元素符号)。
(4)X和Z形成的简单氢化物,热稳定性较好的是______________(填化学式)。
(5)Y与X的最高价氧化物在一定条件下反应的实验现象是___________________________。
(6)下列说法正确的是_______。
A.W的氧化物,均满足8e—稳定结构
B.最高价氧化物对应的水化物的酸性W>Z
C.由于Z的氧化物ZO2既可与酸反应,又能与碱反应,所以ZO2为两性氧化物
D.W的氧化物WO2,具有还原性,能使酸性KMnO4溶液褪色
(7)足量的单质Y与一定量的W的最高价氧化物对应的水化物的浓溶液,在一定条件下充分反应,所得气体的成分为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用0.1000 mol/L的盐酸滴定20.00 mL NaOH溶液,测定其浓度,下列说法正确的是
A.需用NaOH溶液润洗锥形瓶
B.用量筒量取20.00 mL NaOH溶液
C.使用酚酞做指示剂,滴定终点的现象为溶液浅红色褪去,半分钟不变色
D.滴定前,没有除去酸式滴定管中的气泡,滴定后气泡消失,所测浓度会偏小
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:pNi=-lgc(Ni2+);常温下,K(NiCO3)=1.4×10-7,H2S的电离平衡常数:Ka1=1.3×10-7,Ka2=7.1×10-15。常温下,向10mL0.1mol·L-1Ni(NO3)2溶液中滴加0.1mol·L-1Na2S溶液,滴加过程中pNi与Na2S溶液体积的关系如图所示。下列说法不正确的是( )。
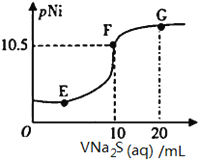
A. E、F、G三点中,F点对应溶液中水电离程度最小
B. 常温下,Ksp(NiS)=1×10-21
C. 在NiS和NiCO3的浊液中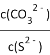 =1.4×1014
=1.4×1014
D. Na2S溶液中,S2-第一步水解常数Kh1=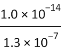
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是0.01 mol/L甲溶液滴定0.01 mol/L乙溶液的导电能力变化曲线,其中曲线③是盐酸滴定NaAc溶液,其他曲线是醋酸滴定NaOH溶液或者NaOH溶液滴定盐酸。下列判断错误的是
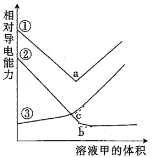
A.条件相同时导电能力:盐酸>NaAc
B.曲线①是NaOH溶液滴定盐酸导电能力变化曲线
C.随着甲溶液体积增大,曲线①仍然保持最高导电能力
D.a点是反应终点
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)俗称海波、大苏打,无色透明晶体,易溶于水,遇强酸反应产生硫单质和二氧化硫气体;具有强还原性,与强氧化剂反应产物为SO42-;
(1)Na2S2O3中S元素的化合价为_________。
(2)向Na2S2O3溶液中滴加稀硫酸,其反应的离子方程式为____________________________。
(3)Na2S2O3溶液与Cl2反应,可作为绵织物漂白后的脱氧剂。该反应的离子方程式为_______,要脱去22.4 L Cl2(标准状况下),需要Na2S2O3________mol。
(4)工业上常用硫化碱法制备海波。其原理是向碳酸钠和硫化钠物质的量之比为1:2的混合液中通入过量的二氧化硫,经蒸发、结晶,即得硫代硫酸钠。其反应的化学方程式为_____,其氧化剂为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%
查看答案和解析>>
科目: 来源: 题型:
【题目】Ca3N2是重要的化学试剂,易潮解、被氧化,实验室用N2和金属钙在加热条件下制备Ca3N2的装置如图所示(已知:钙能在CO2中燃烧)。请回答下列问题:
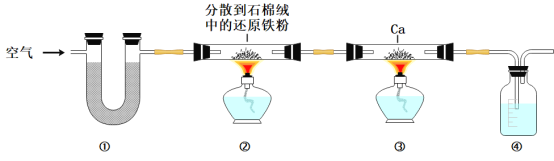
(1)Ca3N2中所含化学键的类型为____________。
A.离子键 B.共价键 C.氢键
(2)装置①中的U型管中的物质为___________,其作用为________________。
(3)装置②的作用为___________________________。
(4)组装好仪器,装入药品,通入空气后,应先点燃____________处酒精灯,再点燃另一个酒精灯。
(5)写出Ca3N2潮解时的化学方程式__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常用燃烧法分析有机物的组成与结构。某化合物样品在足量O2中充分燃烧,生成物只有CO2和H2O。燃烧产物依次经过浓硫酸和碱石灰充分吸收,浓硫酸和碱石灰依次增重7.2g和17.6g。有关该物质的组成和结构推测不合理的是( )
A.该物质可能是烃类化合物
B.该物质结构中可能含C=C
C.该物质结构中可能含苯环
D.该物质结构中可能含羧基
查看答案和解析>>
科目: 来源: 题型:
【题目】水系钠离子电池安全性能好、价格低廉、对环境友好,有着巨大的市场前景。某钠离子电池工作原理如图,电池总反应为:2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
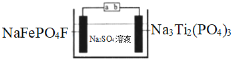
下列说法错误的是
A.充电时,a接电源正极
B.放电时,溶液中的Na+在NaFePO4F电极上得电子被还原
C.充电时,阴极上的电极反应为NaTi2(PO4)3+2Na++2e﹣=Na3Ti2(PO4)3
D.理论上,该电池在充电或放电过程中溶液中的c(Na+)不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.用排饱和食盐水的方法收集氯气
B.500℃左右比室温更有利于工业合成NH3的反应
C.加入催化剂有利于SO2的氧化反应
D.对2HI(g)![]() H2(g) + I2(g),减小容器体积,气体颜色变深
H2(g) + I2(g),减小容器体积,气体颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com