
科目: 来源: 题型:
【题目】草酸铝是一种不溶于水和醇,溶于强酸的白色粉末,是重要的媒染剂。某化学兴趣小组设计实验从废弃铝—空气海水电池中回收铝并制备草酸铝晶体。
【实验过程】
(一)铝的回收
①称取16.0g废弃电池原料;
②用98.3%的硫酸进行酸浸、稀释、除杂、过滤;
③将滤液蒸干得到硫酸铝固体mlg.
(二)草酸铝的制备
④配制250mL0.20mol/L的硫酸铝溶液;
⑤量取0.10mol/L的草酸铵溶液20.00mL,并加入一定量的分散剂,缓缓加入配制的硫酸铝溶液25.00mL,搅拌lh;
⑥沉化、抽滤、洗涤、干燥、称量固体质量为m2g。
【问题讨论】
(1)在用98.3%的硫酸进行酸浸时,浸出率与条件的关系如图所示:

由图可知浓硫酸为浸取剂的最佳条件为________。
(2)步骤③蒸干溶液所需的仪器有带铁圈的铁架台、酒精灯、_______、_______。
(3)铝的回收率为_______ (回收率=回收铝的质量/原料的质量)。
(4)步骤⑥中洗涤晶体时先用蒸馏水再用乙醇洗涤,这样洗涤的原因是_______。
(5)该研究小组在实验过程中发现,若用0.90mol/L草酸铵进行实验,会导致沉淀的质量远超过实际草酸铝的质量。经分析,结晶生成物为(NH4)xAly(C2O4)z·nH2O。 现称取3.990g该结晶水合物进行热分解,得到剩余固体的质量随温度变化的曲线如下图所示。己知450℃时剩余固体只有Al2O3。第II阶段共产生气体2.016L (标准状况),该气体通入足量的石灰水中产生3.000g沉淀。请计算求出该结晶水合物的化学式为______。

查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,水的电离达到平衡: H2O![]() H++ OH-ΔH > 0 ,下列叙述正确的是
H++ OH-ΔH > 0 ,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 向水中加入少量盐酸,c(H+)增大,Kw不变
C. 向水中加入NaOH固体,平衡逆向移动,c(OH-) 降低
D. 向水中加入AlCl3固体,平衡逆向移动,c(OH-) 增大
查看答案和解析>>
科目: 来源: 题型:
【题目】向VmL0.1mol/L氨水中滴加等物质的量浓度的稀H2SO4,测得混合溶液的温度和pOH[pOH=-lgc(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化),下列说法不正确的是( )
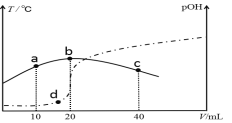
A. a、b、c三点由水电离的c(H+)依次减小
B. V=40
C. b点时溶液的pOH>pH
D. a、b、d三点对应NH3·H2O的电离常数:K(b)>K(d)>K(a)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
科目: 来源: 题型:
【题目】为除去下列物质中少量的杂质(括号内),请写出所加的试剂或操作,并写出相应的化学方程式:
(1)Na2CO3 固体(NaHCO3):______________,___________________________________。
(2)NaCl溶液中混有少量Na2CO3 :_____________,_______________________________。
(3)铜粉中混有铁粉:______________,_______________________________。
(4)铁粉中混有铝粉:______________,_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

请回答下列问题:
(1)金刚烷的分子式为___________,其分子中的CH2基团有______个;
(2)如图是以环戊烷为原料制备环戊二烯的合成路线:

其中,反应④的方程式___________,反应④的反应类型是___________;
(3)已知烯烃能发生如下的反应: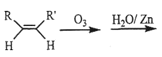 RCHO+R’CHO,请写出下列反应产物的结构简式:___________________。
RCHO+R’CHO,请写出下列反应产物的结构简式:___________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下图为一定条件下采用多孔惰性电极的储氢电池充电装置(忽略其他有机物)。已知储氢装置的电流效率![]() ×100%,下列说法不正确的是
×100%,下列说法不正确的是
A. 采用多孔电极增大了接触面积,可降低电池能量损失
B. 过程中通过C-H键的断裂实现氢的储存
C. 生成目标产物的电极反应式为C6H6+6e-+6H+===C6H12
D. 若![]() =75%,则参加反应的苯为0.8mol
=75%,则参加反应的苯为0.8mol
查看答案和解析>>
科目: 来源: 题型:
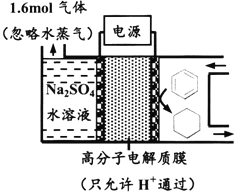
【题目】某课外活动小组用如图装置进行实验,试回答下列问题。

(1)若开始时开关K与a连接,则B极的电极反应式为_____________。
(2)若开始时开关K与b连接,总反应的离子方程式为_______。有关上述(2)实验,下列说法正确的是(填序号)____________。
①溶液中Na+向A极移动
②若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol 电子
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为:_________________。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)______导出。
查看答案和解析>>
科目: 来源: 题型:
【题目】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷通过脱氢反应可得丙烯。
已知:①C3H8(g) → CH4(g)+ C2H2(g) + H2(g) △H1= +156.6 kJ/mol
②C3H6(g) → CH4(g) + C2H2(g ) △H2= +32.4 kJ/mol
则相同条件下,反应C3H8(g) → C3H6(g) + H2(g)的△H=________kJ/mol。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2,负极通入丙烷,电解质是KOH溶液。则燃料电池的负极反应式为_________________。
(3)常温下,0.1 mol/LNaHCO3溶液的pH大于8,则该溶液中c(H2CO3)_____c(CO32-)(填“>”、“=”、“<”),原因是_____________(用离子方程式和必要的文字说明)。
(4)常温下,请写出0.1 mol/LNa2CO3溶液中的各离子浓度大小关系式:_______ ;
查看答案和解析>>
科目: 来源: 题型:
【题目】近期发现,![]() 是继
是继![]() 、
、![]() 之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是__________(填标号)。
A. 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B. 氢硫酸的导电能力低于相同浓度的亚硫酸
C. ![]() 的氢硫酸和亚硫酸的
的氢硫酸和亚硫酸的![]() 分别为
分别为![]() 和
和![]()
D. 氢硫酸的还原性强于亚硫酸
(2)![]() 与
与![]() 在高温下发生反应:H2S(g)+CO2(g)
在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610K时,将0.1mol
COS(g)+H2O(g)。在610K时,将0.1mol![]() 与
与![]()
![]() 充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①![]() 的平衡转化率
的平衡转化率![]() ________%,反应平衡常数
________%,反应平衡常数![]() ___________________。
___________________。
②在620K重复实验,平衡后水的物质的量分数为0.03,![]() 的转化率
的转化率![]() ______
______![]() ,该反应的
,该反应的![]() ______0。(填“
______0。(填“![]() ”“
”“![]() ”或“
”或“![]() ”)
”)
③向反应器中再分别充入下列气体,能使![]() 转化率增大的是______(填标号)。
转化率增大的是______(填标号)。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com