
科目: 来源: 题型:
【题目】为了社会可持续发展,化工生产过程应尽量减少对环境的副作用。“绿色化学”是当今社会提出的一个新概念,它要求从经济、环保和技术上设计可行的化学反应,据此,由单质铜制取硝酸铜的下列衍变关系可行且符合“绿色化学”的是( )
A.Cu![]() Cu(NO3)2
Cu(NO3)2
B.Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C.Cu![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4![]() 2Cu(NO3)2
2Cu(NO3)2
查看答案和解析>>
科目: 来源: 题型:
【题目】酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2=NO+SO3,②2NO+O2=2NO2,③SO3+H2O=H2SO4,以下叙述错误的是
A. NO2由反应N2+2O2![]() 2NO2生成
2NO2生成
B. 总反应可表示为2SO2+O2+2H2O![]() 2H2SO4
2H2SO4
C. 还可能发生的反应有4NO2+O2+2H2O=4HNO3
D. 还可能发生的反应有4NO+3O2+2H2O=4HNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
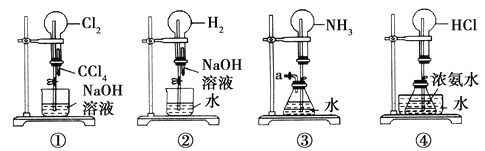
A. 挤压装置①的胶头滴管使CCl4全部进入烧瓶,并打开止水夹
B. 挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,并打开止水夹
C. 用鼓气装置从装置③的a处不断鼓入空气,并打开止水夹
D. 向装置④的水槽中慢慢加入足量浓硫酸,并打开止水夹
查看答案和解析>>
科目: 来源: 题型:
【题目】无机化合物在化工生产和科学研究中发挥着重要的作用。根据题意完成下列计算:
(1)一定温度下,将60mLCO、CO2与O2的混合气体用电火花引燃,完全反应后冷却到原来温度,体积减少了10mL。将反应后的气体通过足量的NaOH(aq),体积又减少了30mL。剩余气体可使带余烬的木条复燃。原混合气中CO的体积为___mL,CO2的体积为___mL。
(2)标准状况下CO与CO2混合气体的平均相对分子质量为32。将该气体完全通入盛有足量Na2O2的容积为2.24升的密闭容器中(忽略固体物质的体积),引燃,完全反应后,容器内固体生成物的质量为___g。
(3)将Fe2O3溶于150mL稀H2SO4中,待Fe2O3完全溶解后,加入铁粉,产生气体3.36L(标准状况),溶液中不再有Fe和Fe3+。已知加入的铁粉和氧化铁共19.2g,计算:
①Fe2O3的质量为(_____)g;
②稀H2SO4物质的量浓度为(_____)。
(4)取5.64gCu(NO3)2无水晶体,强热使其分解,得到NO2、O2和2.32固体氧化物。将气体用水充分吸收后,还有气体剩余,同时得到100mL溶液。请通过计算确定所得溶液的物质的量浓度(_____)(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求作答:
(1)常温下,pH=2的醋酸和pH=12的氢氧化钠等体积混合,混合后溶液呈_____性
(2)25℃时,柠檬水的pH是3,其中氢氧根离子浓度是_______mol/L
(3)已知下列反应:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1= -akJ/mol
②C(s)+O2(g)=CO2(g) △H2= -bkJ/mol
则反应2C(s)+2H2O(l) =CH3COOH(l)的反应热为△H=_____________kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe2+又含有Fe3+。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2+ 11 O2→ 2 Fe2O3+ 8 SO2
② 4 Fe1-xS + (7-3x) O2→ 2 (1-x) Fe2O3+ 4 SO2
(1)含FeS272%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸___________吨(矿石中无其他含硫物质)。
(2)若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为_____:1。
(3)煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数_____(用含x的代数式表示)。
(4)将一定量的磁黄铁矿溶于足量的盐酸,充分反应后测得生成S单质2.4g,FeCl20.425mol,且溶液中无Fe3+,计算Fe1-xS中的x_____值(矿石中其他成分不与盐酸反应)。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:
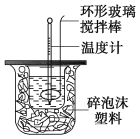
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol): ______。
(2)倒入NaOH溶液的正确操作是________(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ____________________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②上述实验测量结果得出的中和热的数值与57.3 kJ/mol相比偏小,产生的原因可能是(填字母)_________。
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:可逆反应Cu(s)+CO2(g) CuO(s)+CO(g) △H>0
(1)能判断该反应达到平衡的依据是__________。
A.容器内压强保持不变 B.c(CO)保持不变
C.υ正(CO2)=υ逆(CO) D.c(CO2)=c(CO)
(2)该反应的平衡常数表达式为_________________ ;若该反应在体积固定的密闭容器中进行,反应物为过量Cu(s)和CO2,在一定条件下达到平衡状态,如果改变下列条件再达平衡
Ⅰ.升高温度,CO的平衡浓度__________(选填“增大”、“减小”、“不变”下同)
Ⅱ.再通入CO2,CO2的平衡转化率___________
(3)该反应的逆反应速率随时间变化情况如图:从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是_______________
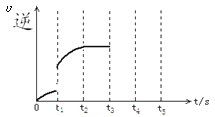
a.升温 b.增大CO2的浓度 c.使用催化剂 d.增压
查看答案和解析>>
科目: 来源: 题型:
【题目】钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
①把一定量烤蓝铁片加工成均匀粉末;
②取m g该粉末,放入28.00 mL 1 mol·L-1的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
完成下列各题:
(1)将反应后的溶液稀释至100 mL,则溶液中c(Fe2+)=________mol·L-1。
(2)样品中n(Fe)∶n(Fe3O4)=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列热化学反应方程式:
(1)1molN2(g)与适量H2(g)起反应生成NH3(g),放出92.2kJ热量:______________。
(2)1molN2(g)与适量O2(g)起反应生成NO(g),吸收68kJ热量:_______________。
(3)1molCu(s)能与一定量的O2(g)起反应生成CuO(s),放出157kJ热量:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com