
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
查看答案和解析>>
科目: 来源: 题型:
【题目】环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
![]()
环己醇、环己酮和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)★ | 0.9624 | 能溶于水 |
环己酮 | 155.6(95)★ | 0.9478 | 微溶于水 |
水 | 100.0 | 0.9982 |
★括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧杯中,在55~60℃进行反应。
反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为_______________。
②蒸馏不能分离环己酮和水的原因是_______________。
(2)环己酮的提纯需要经过以下一系列的操作:
a. 蒸馏,收集151~156℃的馏分; b. 过滤;
c. 在收集到的馏分中加NaCl 固体至饱和,静置,分液;
d. 加入无水MgSO4固体,除去有机物中的少量水。
①上述操作的正确顺序是________(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需__________。
③在上述操作c中,加入NaCl 固体的作用是____________。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有___种不同化学环境的氢原子。
查看答案和解析>>
科目: 来源: 题型:
【题目】某环保部门处理含CN-电镀废水的方法如图(CN-和CNO-中N的化合价均为-3价):
![]()
![]()
![]()
![]()
![]()
某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究。

操作步骤:
ⅰ.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200 mL混合液[其中c(CN-)=0.200mol/L]加入装置甲中,塞上橡皮塞。
ⅱ.待装置甲中充分反应后,打开开关,使溶液全部流入装置乙中,关闭开关。
ⅲ.测定干燥管Ⅰ增加的质量。
(1)写出装置乙中反应的离子方程式:________________________________________。
(2)装置丙中的试剂是_______________,装置丁的作用是_______________________。
(3)假定上述实验中的气体都被充分吸收。若干燥管Ⅰ增重1.408 g。则CN-被处理的百分率为__________。
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将________(填“偏高”、“偏低”、“无法确定”或“无影响”),简述你的理由:________________________________。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10 mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)===NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为___________________________________________________________。
(2)有人设想将CO按下列反应除去:2CO(g)===2C(s)+O2(g) ΔH>0,请你分析该设想能否实现?________(填“能”或“否”),依据是_________________________________________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
①甲酸钠的水溶液呈碱性,请用离子方程式表示其原因________________________________________。
②向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈________(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为_________________________________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
温度 | 固体活性炭/mol | NO/mol | A/mol | B/mol |
200 ℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335 ℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为________(填“吸热”或“放热”)反应。
②200 ℃时,平衡后向恒容容器中再充入0.1 mol NO,再次平衡后,NO的百分含量将________(填“增大”“减小”或“不变”)。
③计算反应在335 ℃时的平衡常数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】4-溴甲基-1-环己烯的一种合成路线如下,下列说法正确的是

A.X、Y、Z都属于芳香族化合物
B.①②③的反应类型依次为加成反应、还原反应和取代反应
C.由化合物Z一步制备化合物Y的转化条件是:NaOH醇溶液,加热
D.化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化可制得化合物X
查看答案和解析>>
科目: 来源: 题型:
【题目】夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏。“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图。已知:苯环上卤素不水解,下列有关说法不正确的是
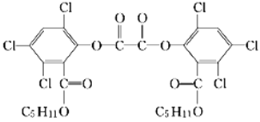
A. 草酸二酯的分子式为C26H24Cl6O8
B. 该有机物能发生加成反应、取代反应、氧化反应
C. 1 mol草酸二酯与氢气完全反应,需要氢气6 mol
D. 1 mol草酸二酯与氢氧化钠稀溶液反应,最多消耗4 mol NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】分子式为C6H12O2的有机物A,有香味。A在酸性条件下水解生成有机物B和C。B能和碳酸氢钠溶液反应生成气体;C不能发生消去反应,能催化氧化生成醛或酮。则A可能的结构有几种( )
A.4B.5C.6D.7
查看答案和解析>>
科目: 来源: 题型:
【题目】珍爱生命,远离毒品.以下是四种毒品的结构简式,下列有关说法正确的是

A.四种毒品中都含有苯环,都属于芳香烃
B.K粉的化学式为C13H15ONCl
C.摇头丸经过消去反应、加成反应可制取冰毒
D.1mol大麻与溴水反应最多消耗4molBr2
查看答案和解析>>
科目: 来源: 题型:
【题目】合成导电高分子材料PPV的反应如下。下列说法正确的是( )
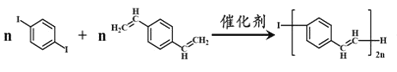 +(2n-1)HI
+(2n-1)HI
A.合成PPV的反应为加聚反应
B.1molPPV最多能与4 molH2发生加成反应
C. 与溴水加成后的产物最多有16个原子共平面
与溴水加成后的产物最多有16个原子共平面
D.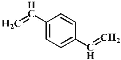 和苯乙烯互为同系物
和苯乙烯互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】白藜芦醇 广泛存在于食物(例如桑椹、花生,尤其是葡萄)中,它可能具有抗癌性。
广泛存在于食物(例如桑椹、花生,尤其是葡萄)中,它可能具有抗癌性。
(1)能够跟1 mol该化合物起反应的Br2或H2的最大用量分别是________。
A.1 mol,1 mol
B.3.5 mol,7 mol
C.3.5 mol,6 mol
D.6 mol,7 mol
(2)下列不能与白藜芦醇反应的是________。
A.Na2CO3溶液
B.FeCl3溶液
C.NaHCO3溶液
D.酸性KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com