
科目: 来源: 题型:
【题目】以0.10mol/L的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示(![]() )。下列表述错误的是( )
)。下列表述错误的是( )
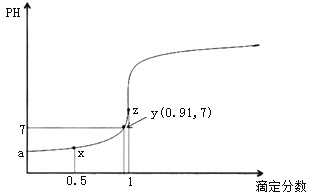
A.z点后存在某点,溶液中的水的电离程度和y点的相同
B.a约为3.5
C.z点处,![]()
D.x点处的溶液中离子满足:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用0.10molL-1盐酸滴定0.10molL-1氨水,滴定过程中NH3H2O、NH4+(假设:溶液中的含氮微粒只有NH3H2O和NH4+)的物质的量分数随pH的变化关系如图所示[例如:δ(NH3H2O)=![]() ]。下列判断正确的是( )
]。下列判断正确的是( )
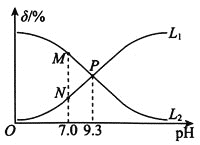
A.曲线L1代表δ(NH4+)与pH的变化关系
B.NH3H2O的电离常数Ka(NH3H2O)=1.0×10-4.7
C.水的电离程度:P>M
D.P点时混合溶液中存在:c(Cl-)=c(NH3H2O)+c(NH4+)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,相同浓度的两种一元酸HX、HY分别用同一浓度的NaOH标准溶液滴定,滴定曲线如图所示。下列说法正确的是![]()
![]()
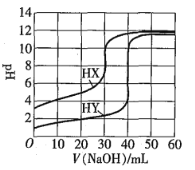
A.HX、HY起始溶液体积相同
B.均可用甲基橙作滴定指示剂
C.pH相同的两种酸溶液中:![]()
D.同浓度KX与HX的混合溶液中,粒子浓度间存在关系式:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈蓝色。下列说法中不正确的是( )
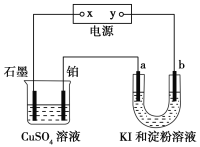
A.x是正极,y是负极 B.a极产生氢气,b极生成I2
C.a极和Pt电极都有气泡产生 D.U形管中溶液的碱性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25 ℃时,HCN的电离常数Ka=6.2×10-10 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1。请根据以下四个图像回答问题。
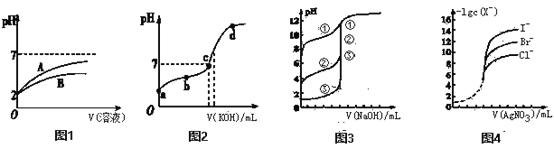
(1)25 ℃时,体积均为100 mL、pH=2的CH3COOH溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图1所示,则表示CH3COOH溶液的pH变化趋势的曲线是:______(填“A”或“B”);相同条件下,NaCN溶液的pH________(填 “>”“=”或“<”)CH3COONa溶液的pH。将0.2 mol·L-1HCN溶液与0.1mol·L-1NaOH溶液等体积混合,则溶液中离子浓度由大到小顺序为______________。(提示:可根据平衡常数大小关系判断反应程度大小)
(2)如图2所示,25 ℃时向20 mL 0.01 mol·L-1CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法正确的是_______
A.a点溶液中c(H+)为1×10-4 mol·L-1
B.a、b、c、d四点中水的电离程度最大的是c点
C.滴定过程中宜选用酚酞做指示剂
D.b点溶液中离子浓度大小顺序一定为c(CH3COO-)> c(H+)>c(K+)>c(OH-)
(3)如图3表示用相同的NaOH溶液分别滴定浓度相同的三种一元酸,由图可知酸性最强的是_____(填“①”“②””或“③” )。
(4)如图4表示相同浓度的AgNO3标准溶液分别滴定浓度相同的含Cl-、Br- 及I-的混合溶液,由图可确定首先沉淀的离子是________。已知25 ℃时Ksp(AgCl)=2×10-10,在1L 0.1mol/L的NaCl溶液中加入1L 0.2mol/L的AgNO3溶液,充分反应后溶液中c(Cl-)=_________(假设混合溶液的体积为2L)
查看答案和解析>>
科目: 来源: 题型:
【题目】(举一反三)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:_____________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:_____________________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:___________________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式:_______________________________。
D的化学式是________。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:_________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题:
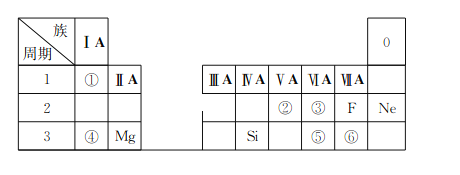
(1)①表示的元素是__________(填元素符号);
(2)②、③两种元素相比较,原子半径较小的是__________(填元素符号);
(3)写出①与⑥两种元素所形成化合物的化学式__________;
(4)③和⑤两种元素的非金属性强弱顺序是③______(填“<”或“>”)⑤;
(5)④和⑥形成化合物的电子式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:常阻下,Ksp.(ZnS)=1.6×10—24;pM=—lgc(M2+)(MI2+为Cu2+或Zn2+)。常温下,向10 mL 0.10 mol/L CuCl2溶液中滴加0.10 mol/L Na2S溶液,滴加过程中pM与Na2S溶液体积(V)的关系如图所示。下列说法错误的是( )
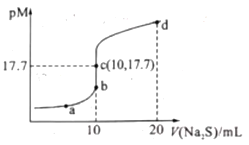
A.Ksp(CuS)的数量级为10-36
B.a点溶液中,c(Na+)=2[c(S2—)+c(HS—)+c(H2S)]
C.d点溶液中:c(Na+)>c(Cl—)>c(S2—)>c(H+)
D.相同条件下,若用等浓度等体积的ZnCl2溶液代替上述CuCl2溶液,则反应终点c向b方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】探究草酸(H2C2O4)的性质,室温下进行以下两组实验:(已知:室温下,H2C2O4的电离平衡常数Ka1=5.0×10-2,Ka2=5.4×10-5)
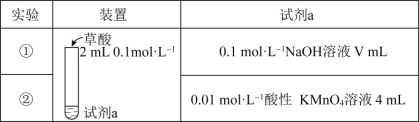
下列有关实验说法正确的是( )
A.若实验①中V=2,则混合后溶液中:c(C2O42-)>c(H2C2O4)
B.若实验①中V=4,则混合后溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
C.实验②反应的离子方程式为5C2O42-+16H++2MnO4-=2Mn2++10CO2↑+8H2O
D.若实验②测得KMnO4溶液的褪色时间为40s,则这段时间内的平均反应速率v(KMnO4)=2.5×10-4molL-1s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室配制480mL 0.1mol/L的CuCl2溶液,实际操作步骤有:
①在天平上称量一定量的CuCl2,放入烧杯,加水溶解;
②把制得的溶液小心地注入容量瓶中;
③继续向容量瓶中加水至距刻度1~2厘米处,改用胶头滴管加水至刻度;
④用少量水洗涤烧杯和玻璃棒2~3次,每次将洗涤液转入容量瓶,并摇匀;
⑤将容量瓶塞塞紧,充分摇匀。填写下列空白:
(1)称量CuCl2的总质量是______;
(2)操作步骤的正确顺序是(填序号)________;
(3)本实验使用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、______;
(4)若没有进行④操作,会使结果(填偏高、偏低或无影响,下同)_____;
(5)若用天平称固体时,砝码上沾有油污,则所配制的溶液浓度将_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com