
科目: 来源: 题型:
【题目】某有机物分子式为 C4H8,据此推侧其结构和性质不可能的是
A. 它与乙烯可能是同系物
B. 一氯代物只有一种
C. 分子结构中甲基的数目可能是 0、1、2
D. 等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8
查看答案和解析>>
科目: 来源: 题型:
【题目】已知二氧化硅,二氧化硫和二氧化碳都是酸性氧化物,化学性质具有一定的相似性,镁和钠的化学性质也具有一定的相似性.
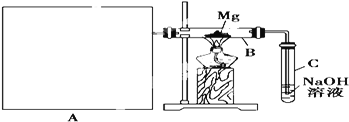
Ⅰ![]() 用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置。
用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置。
(1)选择制取二氧化硫的合适试剂_____________________________![]() 填序号
填序号![]() 。
。
①![]() 的硫酸溶液②
的硫酸溶液②![]() 硫酸溶液③亚硫酸钠固体④亚硫酸钙固体
硫酸溶液③亚硫酸钠固体④亚硫酸钙固体
(2)写出装置B中发生置换反应的化学方程式:_____________________________装置C中氢氧化钠溶液的作用是_____________________________
(3)请在图中画出制备二氧化硫的发生装置,注明仪器名称,固定仪器省略不画。_______________
(4)你认为该装置的不足之处____________________________________________________![]() 任写2条
任写2条![]()
Ⅱ![]() 某研究性学习小组进行了“实验室制硅”的研究,查阅资料知:①工业上在高温时用碳还原二氧化硅可制得硅;②镁在点燃的条件下即可与二氧化硅反应;③金属硅化物与稀硫酸反应生成硫酸盐与四氢化硅;④四氢化硅在空气中自燃.
某研究性学习小组进行了“实验室制硅”的研究,查阅资料知:①工业上在高温时用碳还原二氧化硅可制得硅;②镁在点燃的条件下即可与二氧化硅反应;③金属硅化物与稀硫酸反应生成硫酸盐与四氢化硅;④四氢化硅在空气中自燃.
他们在实验报告中记录着:“![]() 选用合适的物质在适宜的条件下充分反应,再用足量稀硫酸溶解固体产物;然后过滤,洗涤,干燥,最后称量
选用合适的物质在适宜的条件下充分反应,再用足量稀硫酸溶解固体产物;然后过滤,洗涤,干燥,最后称量![]() 在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的
在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的![]() 左右.”
左右.”
(5)该小组“实验室制硅”的化学方程式是_____________________________
(6)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花:的原因是_____________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】综合利用海水资源可以制备氯化铵、纯碱、金属镁等物质,其流程如下:

(1)反应①~⑤中,属于氧化还原反应的是______________(填序号)。
(2)写出反应②的离子方程式__________________________________________________。
(3)X溶液中的主要阳离子是Na+和____________。
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等杂质,为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③_____;④加适量盐酸;⑤_____(请补全缺少的实验步骤)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数。可供选用的试剂有:浓H2SO4、浓硝酸、6 mol·l-1NaOH溶液。
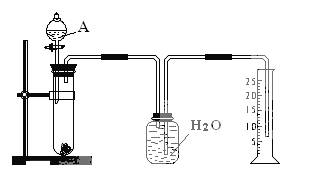
请填写下列空白:
(1)有关实验操作:a、往试管中放入适量的铝合金样品;b、从分液漏斗往试管中加入过量的A溶液;c、检查装置的气密性;d、测定收集到的水的体积。
正确的操作顺序为_________________________________________。
(2)A溶液可选用________________________________________
(3)若实验中测得样品的质量为W g ,氢气的体积为a L(标准状况),则样品中Al的质量分数为_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组研究AgCl的溶解平衡:向10 mL 1mol/L KCl 溶液中加入1 mL 0.2 mol/LAgNO3溶液,将浑浊液均分为2份,进行如下实验:
实验序号 | 实验操作 | 实验现象 |
I | 将其中一份浑浊液过滤,向滤液中放入Mg条
| i. 滤液澄清透明,用激光照射有丁达尔现象。 ii. 放入Mg条后,立即有无色气泡产生,气体可燃,滤液中出现白色浑浊。 iii. 一段时间后开始出现棕褐色浑浊物,Mg条表面也逐渐变为棕褐色,产生气泡的速率变缓慢。 |
II | 向另一份浑浊液中放入大小相同的Mg条
| iv. 棕褐色浑浊物的量明显多于实验I,Mg条表面棕褐色更深,其他现象与ii、iii相同。 |
已知:AgOH不稳定,立即分解为Ag2O(棕褐色或棕黑色),Ag粉为黑色,AgCl、Ag2O可溶于浓氨水生成Ag(NH3)2+
(1)滤液所属分散系为________。
(2)现象ii中无色气泡产生的原因是_________(写出化学方程式)。
(3)现象iii中,导致产生气泡的速率下降的主要影响因素是________。
(4)甲认为Mg条表面的棕褐色物质中一定有Ag和Ag2O,其中生成Ag的离子方程式为____。
(5)甲设计实验检验Ag:取实验I中表面变为棕褐色的Mg条于试管中,向其中加入足量试剂a,反应结束后,继续向其中加入浓硝酸,产生棕色气体,溶液中有白色不溶物。
① 白色不溶物为_____(填化学式),棕色气体产生的原因是_____(写离子方程式)。
② 试剂a为________,加入试剂a的目的是________。
③ 该实验能证明棕褐色物质中一定有Ag的实验现象是________。
(6)甲进一步设计实验验证了Mg条表面的棕褐色物质中有Ag2O,实验方案是:取实验I中表面变为棕褐色的Mg条_________。
(7)综合上述实验,能说明存在AgCl(s) ![]() Ag+(aq) + Cl-(aq)的证据及理由有________。
Ag+(aq) + Cl-(aq)的证据及理由有________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2NO2 ![]() N2O4 △H<0,CaO溶于水放热,NH4Cl晶体溶于水吸热.在3个体积相等的圆底烧瓶中充满等量的NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:(1)中加入CaO,(2)中加入NH4Cl晶体,(3)中不加任何其它物质,如图所示.下列叙述正确的是( )
N2O4 △H<0,CaO溶于水放热,NH4Cl晶体溶于水吸热.在3个体积相等的圆底烧瓶中充满等量的NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:(1)中加入CaO,(2)中加入NH4Cl晶体,(3)中不加任何其它物质,如图所示.下列叙述正确的是( )

A.(1)中红棕色变深,(2)中红棕色变浅
B.(1)中红棕色变浅,(2)中红棕色变深
C.烧瓶(1)中气体的压强不变
D.烧瓶(2)中气体的压强增大
查看答案和解析>>
科目: 来源: 题型:
【题目】高氯酸铵(NH4ClO4)为白色晶体,是强氧化剂,常用作火箭发射的推进剂。已知:①NH4ClO4在400℃时开始分解,产物为N2、Cl2、O2、H2O;②Mg3N2易水解。请用下图所示装置设计实验证明分解产物中含有Cl2、H2O以及装置A中生成了Mg3N2(装置不重复使用)。
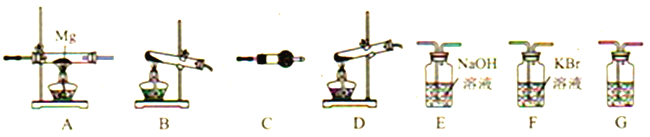
(1)写出高氯酸铵分解的化学方程式__________。
(2)高氯酸铵分解选择的装置是__________(填字母)。
(3)按气流从左到右,装置的连接顺序是:分解装置→_____→_____→_____→_____→_____。______________
(4)C中所放的试剂是__________,G的作用是__________ 。
(5)能证明有Cl2产生的现象是__________。
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是__________。
(7)某实验宣存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为__________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是( )
A.CO32-+H2O![]() HCO3-+OH- 热的纯碱溶液清洗油污
HCO3-+OH- 热的纯碱溶液清洗油污
B.Al3++3H2O![]() Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl 制备TiO2·xH2O
TiO2·xH2O↓+4HCl 制备TiO2·xH2O
D.SnCl2+H2O![]() Sn(OH)Cl+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl+HCl 配制氯化亚锡溶液时加入氢氧化钠
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26 kJmol﹣1
CaO(s)+SiO2(s)═CaSiO3(s)△H2=﹣89.61 kJmol﹣1
写出白磷(P4)由Ca3(PO4)2、焦炭和SiO2在一定条件下反应的热化学方程式为:_____。
(2)电子工业中清洗硅片上的SiO2(s)的反应为SiO2(s)+4HF(g)═SiF4(g)+2H2O(g)△H(298.15 K)=﹣94.0 kJmol﹣1△S(298.15 K)=﹣75.8 Jmol﹣1K﹣1,设△H和△S不随温度而变化,此反应自发进行的温度是_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com