
科目: 来源: 题型:
【题目】在1L恒容密闭容器中充入2a(a>0)molH2和a mol CO,在一定条件下合成甲醇,CO(g)+2H2(g)CH3OH(g),达到平衡时容器内气体压强是起始时的0.6倍。
①在该温度下,平衡常数K=____ (用代数式表示)。
②在该温度下,向此平衡体系中加入a mol CH3OH(g),再次达到平衡后CO的体积分数将____(填“增大”“减小”或“不变”)
③下列情况表明反应达到平衡状态的是____
A.![]() 不再改变
不再改变
B.CO的消耗速率等于CH3OH的生成速率
C.混合气体的密度不再改变
D.混合气体的平均摩尔质量不再改变
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用电解饱和食盐水来制取烧碱,所用的食盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.用盐酸调节滤液的pH,获得一次精制盐水。
(1)过程Ⅰ中除去的离子是______。
(2)表是过程Ⅰ、Ⅱ中生成的部分沉淀及其在20℃时的溶解度(g/100 gH2O):
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
运用表中信息回答下列问题:
①过程Ⅱ中生成的主要沉淀除CaCO3和Mg2(OH)2CO3外还有______。
②过程Ⅰ选用的是BaCl2而不选用CaCl2,原因是______。
③除去Mg2+的离子方程式是______。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是______。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意图如图:
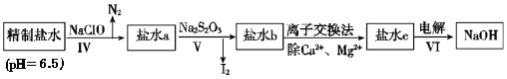
①过程Ⅳ除去的离子是______。
②盐水b中含有SO42-,Na2S2O3将IO3-还原为I2的离子方程式是______。
③在过程Ⅴ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O为了测定其含Na2S2O3·5H2O的纯度,称取8.00 g样品,配制成250.0 mL溶液,取25.00 mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500 mol/L的碘水滴定(发生反应2S2O32-+I2=S4O62-+2I-),滴定达到终点时的现象是______。下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
计算样品的纯度为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.钢铁浸泡于食盐水中发生电化学腐蚀时的正极反应为:2H2O+2e-=H2↑+2OH-
B.增大气体压强或使用催化剂能能提高活化分子的百分数,从而加快反应速率
C.反应2CO(g)=2C(s)+O2(g) ΔS<0在任何条件下都不能自发进行
D.工业上合成氨反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0采用高温是为了提高N2的平衡转化率
2NH3(g) ΔH<0采用高温是为了提高N2的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZnNiOOH二次电池,结构如图所示。电池反应为Zn+2NiOOH+H2O ![]() ZnO+2Ni(OH)2。下列说法正确的是
ZnO+2Ni(OH)2。下列说法正确的是

A.放电时负极附近的pH升高
B.放电过程中OH-通过隔膜从负极区移向正极区
C.充电时3DZn电极应与外接直流电源的正极相连
D.充电时阳极反应为:Ni(OH)2+OH--e-=NiOOH+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】用0.1000 mol·L-1的HCl标准溶液滴定20.00mL未知浓度的NaOH溶液,下列说法正确的是

A.可以用如图所示的装置及操作进行滴定
B.指示剂可以使用紫色石蕊
C.滴加盐酸的速度应保持匀速,且需不断摇荡锥形瓶
D.若滴加盐酸的滴定管滴定前有气泡,滴定终了无气泡,则所测NaOH溶液浓度偏大
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时:
①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH1=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l) ΔH2=-57.3 kJ·mol-1
③Ba2+(aq)+SO42—(aq)=BaSO4(s) ΔH3<0
下列说法正确的是( )
A.HF的电离方程式及热效应:HF(aq)=H+(aq)+F-(aq) ΔH>0
B.在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大
C.ΔH2=-57.3 kJ·mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热
D.稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-114.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是
A.Al2O3![]() AlCl3(aq)
AlCl3(aq) ![]() 无水AlCl3B.Fe
无水AlCl3B.Fe![]() Fe2O3
Fe2O3![]() Fe(OH)3
Fe(OH)3
C.NH4Cl![]() NH3
NH3![]() NOD.稀盐酸
NOD.稀盐酸![]() Cl2
Cl2![]() Ca(ClO)2
Ca(ClO)2
查看答案和解析>>
科目: 来源: 题型:
【题目】“低碳经济”是建设美丽中国的发展方向。
(1) 已知:① CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.1kJ/mol
② 2H2(g)+CO(g)=CH3OH(l) ΔH2=-128.3kJ/mol
③ 2H2(g)+O2(g)=2H2O(g) ΔH3=-481.9kJ/mol
常温下,在合适催化剂的作用下,采用CH4和O2一步合成液态CH3OH的热化学方程式为____。
(2) 二甲醚(CH3OCH3)是清洁能源。利用合成气合成二甲醚的原理是2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH<0。在一定条件下,在反应中CO的平衡转化率α(CO)与温度(T)、投料比n(H2)/n(CO)的关系如图1所示,平衡常数K与温度(T)的关系如图2所示。
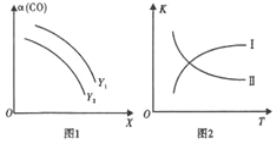
①图1中,X代表____;Y1____Y2 (填“>”“<”或“=”)。
②图2中,曲线____(填I或II)符合平衡常数变化规律。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属镍在工业上应用广泛,请回答下列问题。
(1) Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是____(用元素符号表示)。
(2) 过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=____。与CO互为等电子体的阴离子是____(只写一种),CO分子内σ键与π键个数之比为____。1mol Ni(CO)n中含σ键为____ mol。
(3) 甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醛分子内C原子的杂化方式为____,甲醇分子内的O—C—H键角____(填“大于”“等于”或“小于”)甲醛分子内的O—C—H键角。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com