
科目: 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
①仪器m的名称为___,装置F中试剂的作用是___。
②装置连接顺序:A→___→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___(填“可行”或“不可行”),原因是___。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:

①W溶液可以是___(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____(用含V、m的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是![]()
A.动物体内葡萄糖被氧化成![]() 是热能转变成化学能的过程
是热能转变成化学能的过程
B.![]() 与
与![]() 反应生成
反应生成![]() 沉淀时放出的热叫做中和热
沉淀时放出的热叫做中和热
C.热化学方程式中的化学计量数只表示物质的量,可以是分数
D.![]() 与
与![]() 反应放出的热就是
反应放出的热就是![]() 的燃烧热
的燃烧热
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物X的结构如图所示,下列说法正确的是

A.能使酸性高锰酸钾溶液褪色
B.X分子中含有2个手性碳原子
C.能与FeCl3溶液发生显色反应
D.1 mol X最多能与5 mol H2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO3-和Cl-,研究小组用如图实验装置制取氯酸钾(KClO3),并测定其纯度。
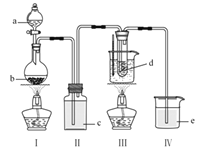
a为浓盐酸 b为MnO2 c为饱和食盐水 d为30%KOH溶液 e为NaOH溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置Ⅲ水温升至![]() 开始反应。
开始反应。
①写出装置Ⅰ中反应的化学方程式为______。
②若取消装置Ⅱ,对本实验的影响是______。
③实验结束,拆解装置Ⅰ前为了防止大量氯气逸出,可采取的措施是______。
④从装置Ⅲ的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和______。
(2)已知碱性条件下,ClO-有强氧化性,而ClO3-氧化性很弱。设计实验证明:碱性条件下,H2O2能被ClO-氧化,而不能被ClO3-氧化。______。
(3)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45 g样品溶于水配成250 mL溶液。
步骤2:取25.00 mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分振荡,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3-+6I-+6H+=Cl-+3I2+3H2O)
步骤4:加入指示剂,用0.5000 mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00 mL(2S2O32-+I2=S4O62-+2I-)
![]() 步骤2的目的是______。写出煮沸时反应的化学方程式______。
步骤2的目的是______。写出煮沸时反应的化学方程式______。
![]() 样品中KClO3的质量分数为______。(KClO3相对分子质量:122.5)
样品中KClO3的质量分数为______。(KClO3相对分子质量:122.5)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.常温下,向0.1 mol·L1 CH3COONa中加入少量水,溶液中![]() 比值减小
比值减小
B.用0.1 mol·L1 NaOH溶液分别中和等体积等pH的盐酸和醋酸,盐酸消耗NaOH溶液的体积大
C.常温下,pH=10的氨水中,由水电离出的OH-浓度为1×10-4mol·L1
D.常温下,向10 mL pH=2的盐酸中分别加入V1 mL的水和V2 mL pH=12的NaOH溶液,所得溶液的pH均为3,忽略混合时溶液体积的变化,则V1∶V2=11∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、50 mL 0.50mol/L盐酸、50 mL 0.55mol/LNaOH溶液,实验尚缺少的玻璃用品是____、____。
(2)NaOH稍过量的原因是_______。
(3)实验中若改用60 mL 0.50 mol/L盐酸和50 mL 0.55 mol/LNaOH溶液进行上述反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热____(填“相等”或“不相等”),理由是________。
(4)他们记录的实验数据如下:
实 验 用 品 | 溶液温度 | ||
t1 | t2 | ||
① | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.3 ℃ |
50 mL 0.50mol/L盐酸 | |||
② | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.5 ℃ |
50 mL 0.50mol/L盐酸 | |||
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 J/(℃g),各物质的密度均为1 g/cm3。根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:____。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)______(填“偏大”“偏小”或“不变”),其原因是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]____。
(2)根据元素周期律,元素的电负性Ga____(填“大于”或“小于”,下同)As,第一电离能B____Ga;BF3和NH3的分子能够通过配位键相结合的原因是____。
(3)杀虫剂Na3AsO4中阴离子的空间构型为____,As原子采取____杂化。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是____。
(5)原子晶体GaAs的晶胞参数a=x pm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为____;该晶体的密度为______g/cm3(阿伏加德罗常数的值用NA表示)。
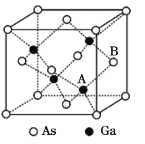
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或表示方法中,正确的是
A.等质量的硫蒸气和硫黄分别完全燃烧,前者放出的热量多
B.a ℃、b kPa下,将0.5 mol O2和1.5 mol H2置于密闭容器中充分反应生成H2O(g),放热c kJ,其热化学方程式为2H2(g)+O2(g)=2H2O(g) ΔH=-2c kJ·mol-1
C.常温常压下,2.8 g CO气体完全燃烧放出的热量为28.26 kJ,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·mol-1
D.稀硫酸溶液与稀NaOH溶液反应的中和热为57.3 kJ·mol-1,则稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
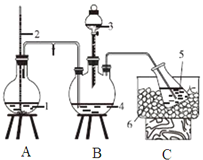
【题目】某科学家在实验室中将CoCl2·6H2O溶解在煮沸的NH4Cl溶液后,趁热倒入盛有少量活性炭的锥形瓶中,冷却后依次加入浓氨水和H2O2,经过一系列的反应,最终制得了一种橙黄色晶体X,为确定其组成,进行如下实验:
实验一、氨的测定:精确称取w gX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mLc1 mol/L的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mLNaOH溶液。
实验二、氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)
回答下列问题:
(1)图中2是一个长玻璃管,其作用原理是______。
(2)样品中氨的质量分数表达式为______。
(3)测定氨前应进行的操作是______。
(4)测定氯的过程中,使用棕色滴定管的原因是______,滴定终点的现象是______,若溶液中c(Ag+)=2.0×10-5mol/L,c(CrO42-)为______mol/L。(已知:Ksp(Ag2CrO4=1.12×10-12)
(5)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,钴的化合价为______,X的制备过程中温度不能过高的原因是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com