
科目: 来源: 题型:
【题目】某铅酸蓄电池的工作原理如图所示,其总反应式为![]() 。下列判断不正确的是
。下列判断不正确的是
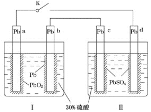
A.闭合K时,d电极的反应式为![]()
B.当电路中转移![]() 电子时,Ⅰ中消耗的
电子时,Ⅰ中消耗的![]() 为
为![]()
C.闭合K时,Ⅱ中![]() 向c电极迁移
向c电极迁移
D.闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室制取纯净、干燥氯气的实验装置。

请回答:
(1)装置①的烧瓶中发生反应的化学方程式___。
(2)装置③中所盛试剂的名称是____。
(3)在③~⑤中,有明显错误的一个装置是___(填序号)。
(4)装置⑤的作用是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( )

A.![]() 闭合,铁棒上发生的反应为
闭合,铁棒上发生的反应为![]()
B.![]() 闭合,石墨棒周围溶液pH逐渐降低
闭合,石墨棒周围溶液pH逐渐降低
C.![]() 闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.![]() 闭合,电路中通过
闭合,电路中通过![]() 个电子时,两极共产生
个电子时,两极共产生![]() 气体
气体
查看答案和解析>>
科目: 来源: 题型:
【题目】某可逆反应aA+bB![]() cC在某温度下的平衡常数为K(K≠1),反应热为ΔH。保持温度不变,将方程式的书写作如下改变,则ΔH和K数值的相应变化为( )
cC在某温度下的平衡常数为K(K≠1),反应热为ΔH。保持温度不变,将方程式的书写作如下改变,则ΔH和K数值的相应变化为( )
A.写成2aA+2bB![]() 2cC,ΔH值、K值均扩大了一倍
2cC,ΔH值、K值均扩大了一倍
B.写成2aA+2bB![]() 2cC,ΔH值扩大了一倍,K值保持不变
2cC,ΔH值扩大了一倍,K值保持不变
C.写成cC![]() aA+bB,ΔH值、K值变为原来的相反数
aA+bB,ΔH值、K值变为原来的相反数
D.写成cC![]() aA+bB,ΔH值变为原来的相反数,K值变为原来的倒数
aA+bB,ΔH值变为原来的相反数,K值变为原来的倒数
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F、G、H、I是中学化学中常见的九种化合物,其中B常温下为无色无味透明的液体,C的焰色反应火焰呈黄色,E是红棕色的固体;X、Y是两种常见的单质,其中X常温常压下为气体.
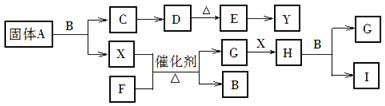
根据上面框图关系回答下列问题:
(1)A的化学式为______,常温下A的颜色为______,I的化学式为______.
(2)写出X+F![]() G+B的化学方程式:______.
G+B的化学方程式:______.
(3)写出实验室中用两种固体药品制取F气体的化学方程式:______.
(4)写出“![]() ”反应的离子方程式:______.
”反应的离子方程式:______.
(5)写出“![]() 金属单质
金属单质 两性氧化物”的化学方程式:______.
两性氧化物”的化学方程式:______.
查看答案和解析>>
科目: 来源: 题型:
【题目】在K2Cr2O7溶液中存在下列平衡:![]() (黄色)+2H+
(黄色)+2H+![]() (
(![]() 橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使
橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使![]() 的物质的量增大,可以在溶液中加入①H+ ②OH- ③K+ ④
的物质的量增大,可以在溶液中加入①H+ ②OH- ③K+ ④![]() ( )
( )
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:

据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学按右图所示的装置进行实验。 A、B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42-从右向左移动。下列分析正确的是

A.溶液中A2+浓度减小
B.B 的电极反应: B-2eˉ=B2+
C.y 电极上有 H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
查看答案和解析>>
科目: 来源: 题型:
【题目】物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):

(1)写出用惰性电极电解M溶液的离子方程式_______________________。
(2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是_________________。
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_______________。
(4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是__________________________________。
(5)若A是一种溶液,只可能含有![]() 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为_________。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为_________。

查看答案和解析>>
科目: 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________________________。利用反应6NO2+ 8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___________L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___________L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的 ΔH=_____________kJ·mol-1。
SO3(g)+NO(g)的 ΔH=_____________kJ·mol-1。
一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,测得平衡时NO2与SO2体积比为1∶6,则平衡常数K=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com