
科目: 来源: 题型:
【题目】某实验小组模拟合成氨过程,通过仪器测得正反应速率与时间的图象如下图所示,请回答相关问题:
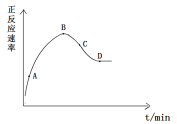
(1)合成氨过程需加入催化剂,催化剂是通过_________来增大反应速率的。
(2)正反应速率呈现出先增大后减小的原因可能是___________。
(3)v正-t图象中A、B、C、D四点属于平衡状态的是___点,你的理由是___。
(4)请在图中画出相应的逆反应速率图象_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是

A. 由图甲可知,升高温度醋酸钠的水解程度增大
B. 由图乙可知,a点Kw的数值比b点Kw的数值大
C. 由图丙可知,反应A(g)+B(g) ![]() 2C(g)是吸热反应
2C(g)是吸热反应
D. 由图丁可知,反应C(金刚石,s)= C(石墨,s)的焓变△H=△H1—△H2
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1,H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为_______。
Ⅱ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。

(1)该反应的化学方程式为___________________ 。
(2)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是____________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示,则K1、K2、K3之间的大小关系为___________。
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
查看答案和解析>>
科目: 来源: 题型:
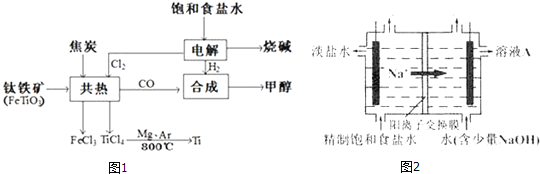
【题目】我国钛资源丰富,攀枝花和西昌已探明钛矿储量就有几十亿吨,其重要的矿石有金红石![]() 、钛铁矿
、钛铁矿![]() 以及钒钛铁矿.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率.
以及钒钛铁矿.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率.
![]() 常温下为无色液体,具有刺激性气味,极易水解,其化学键类型为 ______ ,写出
常温下为无色液体,具有刺激性气味,极易水解,其化学键类型为 ______ ,写出![]() 水解的方程式 ______
水解的方程式 ______
![]() 写出钛铁矿与焦炭、
写出钛铁矿与焦炭、![]() 共热得到
共热得到![]() 的化学方程式: ______
的化学方程式: ______
![]() ①
① ![]()
②![]()
请写出上图中![]() 生成Ti的热化学反应方程式: ______
生成Ti的热化学反应方程式: ______
![]() 海绵钛可用碘提纯,原理为
海绵钛可用碘提纯,原理为![]()
![]() 下列说法正确的是 ______
下列说法正确的是 ______
A 该反应正反应的![]()
B 在不同温度区域,![]() 的量保持不变
的量保持不变
C 在提纯过程中,![]() 的作用是将粗钛从低温区转移到高温区
的作用是将粗钛从低温区转移到高温区
D 在提纯过程中,![]() 可循环利用
可循环利用
![]() 钛网做阳极电解饱和食盐水常用隔膜电解槽.图2为阳离子交换膜电解槽示意图.
钛网做阳极电解饱和食盐水常用隔膜电解槽.图2为阳离子交换膜电解槽示意图.
①该电解装置阳极在 ______ ![]() 填左室、右室
填左室、右室![]() 氯碱工业电解槽一般采用Ti网作阳极而不用Fe网,其原因是 ______ .
氯碱工业电解槽一般采用Ti网作阳极而不用Fe网,其原因是 ______ .
②右室中加入少量NaOH的原因是 ______ .
![]() 在上述产业链中合成112t甲醇理论上能生产Ti ______
在上述产业链中合成112t甲醇理论上能生产Ti ______ 不考虑生产过程中物质的任何损失
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O〔三草酸合铁(Ⅲ)酸钾晶体〕是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂。下图是在实验室制备K3[Fe(C2O4)3]·3H2O的流程:

回答下列问题:
(1)步骤I中加入稀硫酸的目的是_______________。
步骤II中发生的主要化学反应为一可逆过程,其离子方程式为_______________。
常温下,该反应的平衡常数K=_______________[已知常温下:Ka1(H2C2O4)=5.6×10-2、Ka2(H2C2O4)=5.4×10-5、Ksp(FeC2O4)=2.1×10-7]
(2)下列试剂均可将FeC2O4氧化为K3[Fe(C2O4)3],最适宜作为“试剂a”的是_______________(填序号)
a.氯水b.酸性KMnO4溶液c.H2O2溶液d.稀硝酸
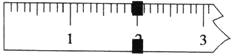
(3)使用托盘天平称量制得的K3[Fe(C2O4)3]·3H2O的质量。天平平衡时,右盘内砝码的总质量为20 g.游码示数如图所示,则制得晶体的质量为___________g,该实验中K3[Fe(C2O4)3]·3H2O的产率为_______________。(已知: K3[Fe(C2O4)3]·3H2O的相对分子质量为491,FeSO4·7H2O的相对分子质量为278)
(4)某研究小组将K3[Fe(C2O4)3〕在一定条件下加热分解后,利用下图所示装置(可重复使用)确认所得含碳元素的气体产物为CO和CO2。

按气流从左到右的方向,装置的连接顺序为_______________(填装置序号) ;确认气体产物中含CO的现象为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:
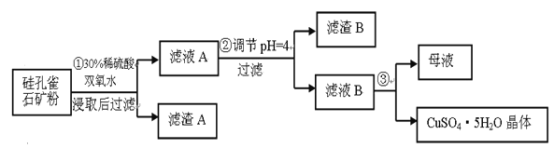
(1)完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4+_______+H2O;双氧水的作用是_________________。
(2)步骤②调节溶液pH,可以选用的试剂是______。
A.CuO | B.Fe2O3 | C.Al2O3 | D.Cu(OH)2 |
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为_____,滤液B中除Cu2+外, 还含有的金属阳离子是_______。
(4)将滤液B通过________、_______,过滤等操作可得到硫酸铜晶体。
(5)测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某种氢氧燃料电池的电解质溶液为KOH溶液,下列有关该电池的叙述错误的是( )
A.正极反应式为:O2+2H2O+4e-═4OH
B.工作一段时间后,电解液中KOH的物质的量浓度不变
C.该电池的总反应式为:2H2+O2═2H2O
D.当该电池生成9g水时,通过电路的电子为1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)工业制硫酸铜的方法很多。
① 方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是________,此法的最大缺点是__________。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:

稀硫酸、铜和氧化铁反应的化学方程式是_________________;向混合溶液中通入热空气的反应的离子方程式是___________________;由滤液得到无水硫酸铜的实验操作是______________。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:

①吸收塔中发生反应的化学方程式是_______________________。
② 有数据表明,吸收塔中溶液的pH在5.5~6.0之间,生产效率较高。当控制一定流量的尾气时,调节溶液的pH的方法是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列化合物:①HCl ②NaOH ③NH4Cl ④CH3COONa ⑤CH3COOH ⑥NH3H2O⑦Na2CO3,请根据字母序号提示的物质回答下列问题。
(1)③溶液中离子浓度大小顺序为______________________。用离子方程式表示⑦溶液显碱性的原因_______________________________。
(2)常温下,pH=11的④的溶液中,由水电离出来的c(OH-)=____________。已知常温下⑤和⑥的电离常数均为1.7×10-5 mol·L-1,则反应:CH3COOH+NH3H2O![]() CH3COO-+NH4++H2O的平衡常数为______________。
CH3COO-+NH4++H2O的平衡常数为______________。
(3)常温下,关于pH值相同的①和⑤两种溶液,下列说法不正确的是________。
A.两种溶液中水的电离程度相同 B.c(CH3COO-)=c(Cl-)
C.c(CH3COOH)>c(HCl) D.与等浓度的氢氧化钠溶液反应,醋酸消耗的体积少
(4)常温下,将0.10 mol/L的①溶液和0.30 mol/L;②溶液等体积混合,充分反应后恢复至常温,溶液的pH=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )(已知:pH=-lgc(H+))

A.将稀醋酸加水稀释时,c(H+)减小,c(OH-)也减小
B.a、b、c三点溶液的pH:b<a<c
C.a、b、c三点CH3COOH的电离程度:c<a<b
D.a、b、c三点溶液用1 mol·L-1NaOH溶液中和,消耗NaOH溶液体积:c<a<b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com