
科目: 来源: 题型:
【题目】如下图所示操作能实现实验目的的是( )
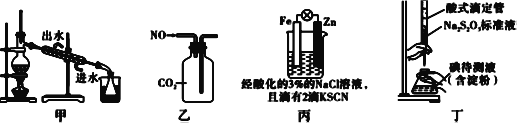
A. 用图甲装置分离碘和四氯化碳,在锥形瓶中收集到碘单质
B. 用图乙装置收集NO气体
C. 用图丙装置验证牺牲阳极的阴极保护法
D. 用图丁装置测定待测液中I2的含量
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
(1)写出下列物质的分子式:含6个碳原子的链状单烯烃__________________________。
(2)在戊烷的各种同分异构体中,一氯代物种类最多的键线式是_________________。
(3)用系统命名法命名 :______________
:______________
(4)某化合物的分子式为C5H11Cl,分析数据表明:分子中有两个-CH3、两个-CH2-、一个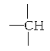 和一个-Cl。它的可能的结构有______________种
和一个-Cl。它的可能的结构有______________种
查看答案和解析>>
科目: 来源: 题型:
【题目】电解原理和原电池原理是电化的两个重要内容。某兴趣小组做如下探究实验:
(1)如图为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为_____________。反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过_______mol电子。

(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极的反应式为________________。
(3)如图,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,乙装置中石墨(2)电极上发生的反应式为_________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】向10.0 mL 0.10 mol/L氨水中滴入0.10 mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出)。下列有关叙述正确的是( )

A. M~N间一定存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B. M点对应的盐酸体积为10.0 mL
C. P点处的溶液中存在:2c(NH4+)+2c(NH3·H2O)=c(Cl-)
D. pH=7的溶液中:c(NH4+)=c(Cl-)=c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
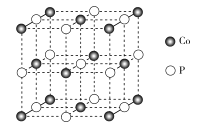
【题目】纳米磷化钻常用于制作特种钻玻璃,制备磷化钻的常用流程如图:
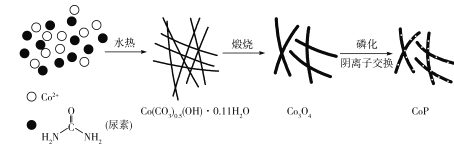
(1)基态P原子的电子排布式为___。P在元素周期表中位于___区。
(2)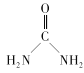 中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
(3)CO32-中C的价层电子对数为___,其空间构型为___。
(4)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm。设NA为阿伏加德罗常数的值, 则其晶胞密度为___g.cm-3(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】还原法处理氮的氧化物是环境科学研究的热点课题。
I.氧气还原法。H2还原NO发生的反应为:2NO(g)+2H2(g)![]() N2(g)+2H2O(g)。
N2(g)+2H2O(g)。
(1)已知儿种化学键的键能数据如下:

2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH=___kJ·mol-1。
N2(g)+2H2O(g) ΔH=___kJ·mol-1。
(2)2NO(g)+2H2(g)![]() N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
反应1:2NO(g)+H2(g)![]() N2(g)+H2O2(g);
N2(g)+H2O2(g);
反应2:H2O2(g)+H2(g)![]() 2H2O(g)。
2H2O(g)。
总反应速率由反应较慢的一步决定,由此推知上述两步反应中,活化能较大的是反应___(填“l”或“2”)。c(NO)对总反应速率的影响程度___c(H2)(填“大于”“小于”或“等于”)。
Ⅱ.NH3还原法。在恒容密闭容器中充入NH3和NO2,在一定温度下发生反应:8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g)。
7N2(g)+12H2O(g)。
(3)下列表明该反应达到平衡状态的是___(填字母)。
A.混合气体密度保持不变 B.NO2和N2的消耗速率之比为6:7
C.混合气体中c(N2)=c(NO2) D.混合气体压强保持不变
III.CO还原法。利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH。在2L恒容密闭容器中充人2molCO和2molNO,测得NO的转化率与温度、时间的火系如图所示。
N2(g)+2CO2(g) ΔH。在2L恒容密闭容器中充人2molCO和2molNO,测得NO的转化率与温度、时间的火系如图所示。
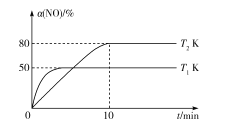
(4)下列说法正确的是___(填字母)。
A.图像中,T1>T2
B.上述反应在高温下能自发进行
C.10min时,T2K下正、逆反应速率相等
D.增大NO的浓度,反应物的转化率增大
(5)T2K温度下,0-10min内用CO表示的平均反应速率v(CO)=___mol/L-1·min-1;T1K温度下,上述反应的平衡常数K=___L·mol-1。
(6)T1K温度下,向平衡后的容器内再加入2molN2和2molNO,则平衡___(填“向右移动”“向左移动”或“不移动”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某探究活动小组根据侯德榜制碱原理,按下面设计的方案制备碳酸氢钠。实验装置如下图所示(图中夹持、固定用的仪器未画出)。下列说法正确的是

A. 乙装置中盛放的是饱和食盐水
B. 丙装置中的溶液变浑浊,因有碳酸氢钠晶体析出
C. 丁装置中倒扣的漏斗主要作用是防止产生的气体污染空气
D. 实验结束后,分离碳酸氢钠的操作是蒸发结晶
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,则以下说法正确的是
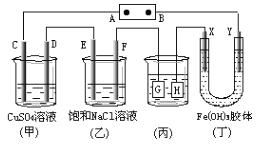
A. 电源B极是正极
B. 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷
C. 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D. (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2
查看答案和解析>>
科目: 来源: 题型:
【题目】白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。

下列推断不正确的是
A. 无色溶液B的pH≥7
B. 白色固体F的主要成分是H2SiO3
C. 混合物A中有Na2SiO3、CuSO4和CaCO3
D. 在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com