
科目: 来源: 题型:
【题目】下列说法正确的是
A.等质量的甲烷、乙烯、1,3—丁二烯分别充分燃烧,所耗用氧气的量依次减少
B.按系统命名法,化合物![]() 的名称为2—甲基—4—乙基戊烷
的名称为2—甲基—4—乙基戊烷
C.苯酚、水杨酸( )和苯甲酸都是同系物
)和苯甲酸都是同系物
D.三硝基甲苯的分子式为C7H3N3O6
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有机物说法不正确的是( )
A. 对甲基苯乙烯中最多有17个原子共面
B. 萘环(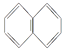 )上的一个H原子被-C4H9取代后的产物共有8种
)上的一个H原子被-C4H9取代后的产物共有8种
C. BrCH2CHBrCH2Br的名称为三溴丙烷
D. 立方烷(![]() )一氯代物1种、二氯代物有3种、三氯代物也有3种
)一氯代物1种、二氯代物有3种、三氯代物也有3种
查看答案和解析>>
科目: 来源: 题型:
【题目】水资源非常重要,联合国确定2003年为国际淡水年.海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程![]() 又称海水脱盐
又称海水脱盐![]() ,其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等.下列方法中也可以用来进行海水淡化的是
,其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等.下列方法中也可以用来进行海水淡化的是
A.过滤法B.蒸馏法C.萃取法D.蒸发法
查看答案和解析>>
科目: 来源: 题型:
【题目】已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表:
元素 | 结构或性质信息 |
T | 原子的L层上s电子数等于p电子数 |
X | 元素的原子半径是第三周期主族元素中最大的 |
Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子 |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______________;
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______________;
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______________;
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是_________、___________;
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是__________(选填“甲”、“乙”、“丙”)。
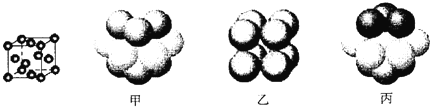
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素。已知:①F的单质为生活中最常见的金属之一,原子最外层有2个电子;②E原子的价电子排布为msnmpn,B原子的核外L层电子数为奇数;③A、D原子p轨道的电子数分别为2和4.请回答下列问题:
(1)F的稳定价态离子的电子排布式是__________________________;A、B、D、E四种元素的第一电离能由大到小的顺序为________________(用元素符号表示)。
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是________________。分子的立体构型为________________,该氢化物易溶于D的简单氢化物的主要原因是________________。
(3)D原子分别与A、B原子形成的单键中,键的极性较强是________________(用具体的化学键表示)。
(4)如图所示的晶胞是由AD两元素组成的,下列有关该晶体的说法中正确的是_______。

a.该晶体的化学式为AD
b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高
d.该晶体可溶于水
查看答案和解析>>
科目: 来源: 题型:
【题目】煤和石油不仅是重要的矿物能源,更可以通过综合利用得到多种有机化工产品。煤干馏后可得到焦炭、煤焦油、粗氨水和焦炉气等。焦炭可通过以下途径制取聚氯乙烯等化工产品。
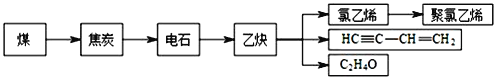
完成下列填空:
(1)石油化工生产乙烯的操作名称为___,乙炔的分子空间构型是____,由乙炔生产HC≡C-CH=CH2的基本反应类型是___。在石油生产乙烯的过程中会产生副产品异戊烯,通过催化脱氢法得到异戊二烯,进而通过1,4-加聚反应得到异戊橡胶,由异戊二烯生产异戊橡胶的化学方程式为:___。
(2)乙炔可用来合成聚氯乙烯。请以乙炔为原料,无机试剂任选,设计聚氯乙烯的合成路线。____
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______。
(2)该反应为______反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_____。
a.容器中压强不变 b.υ正(H2)=υ逆(H2O)
c. c(CO2)=c(CO) d.混合气体中 c(CO)不变
(4) 830K时,各物质浓度符合下式:2c(CO2)·c(H2)=c(CO)·c(H2O),此时该反应 _______(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”)。
Ⅱ.将1 mol I2(g) 和2 mol H2置于2 L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)若5分钟该达平衡,则用H2表示的反应速率为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,则甲条件可能是____。(填入下列条件的序号)
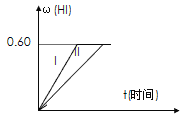
①恒温条件下,缩小反应容器体积;②恒温条件下,扩大反应容器体积;③恒容条件下,降低温度;④恒容条件下,升高温度;⑤恒温恒容条件下,加入适当催化剂。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;B、C、D同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题: (相关问题用元素符号表示)
(1)写出E的基态原子的电子排布式________________________。
(2)B与C可形成化合物BC和BC2,BC2属于__________(填“极性”、“非极性”)分子,1 mol BC含有π键为____________________mol。
(3)由元素A、C、G组成的离子[G(A2C)4]2+在水溶液中显天蓝色,不考虑空间结构,[G(A2C)4]2+的结构可用示意图表示为__________(配位键用→标出)。
(4)测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的原因是_______。
(5)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质,分子中含三个相同的原子团,其结构简式为________________,分子中F原子的杂化方式为__________,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为____________________。
(6)G与氮元素形成的某种化合物的晶胞结构如图,则该化合物的化学式为__________,若晶体密度为a g·cm-3,列式计算G原子与氮原子最近的距离为__________pm(不必计算出数值,阿伏加德罗常数的值用NA表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W四种元素原子序数依次增大且均小于36。Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子。 回答下列问题(以下问题均以推知元素符号作答):
(1)若YX3与X2Z、YX2-与ZX-、Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式_________________。
(2)已知X2Z晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因与下列因素有关的是______。
①氢键的方向性 ②氢键的饱和性 ③水中氧的杂化方式与金刚石中碳的杂化方式一样 ④晶体类型相似
(3) WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为_________,其核外电子有________种运动状态。
②尿素分子中碳原子的杂化方式为_________,1mol尿素分子中含有的σ键数为______NA。
③YZ3-的空间构型________,与之互为等电子体的阴离子如________,中性分子如________;HYZ3与HYZ2 中酸性偏强的是(写化学式)__________。
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如下图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6:91。若该晶体的化学式为WxZ,则x=_____。

查看答案和解析>>
科目: 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为______。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,E(H﹣Cl)=432kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣H)=_____。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,C(s)+
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1,则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____。
O2(g)═CO(g)△H=﹣110.5kJmol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1,则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____。
(4)如图是N2(g)和H2(g)反应生成2molNH3(g)过程中能量变化示意图:
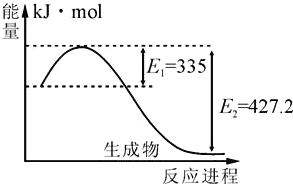
①请计算每生成1molNH3放出热量为:______。
②若起始时向容器内充入1molN2和3molH2达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com