
科目: 来源: 题型:
【题目】某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验③发生的反应的离子方程式为_____________________________。
(2)上述实验说明黑色粉末X中含有_______________________________。
II.定量测定
根据下图所示的实验方案进行实验并记录数据:
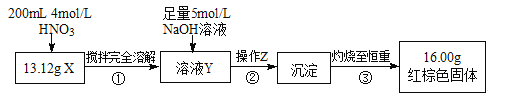
(1)操作Z的名称是_________。
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为_________。
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备四水甲酸铜[Cu(HCOO)24H2O]晶体实验步骤如下。
(1)碱式碳酸铜的制备:
a.步骤i是将一定量胆矾和碳酸氢钠固体一起放到研钵中研磨,其目的是______。
b.步骤ii是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到_____(写实验现象),说明温度过高。
c.相关的化学方程式______。
(2)四水甲酸铜晶体的制备:将碱式碳酸铜固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,乘热过滤除去少量不溶性杂质,然后蒸发冷却过滤,在用少量无水乙醇洗涤晶体2—3次晾干,得到产品。
a.相关的化学方程式______。
b.趁热过滤中,必须趁热的原因是______。
c.用乙醇洗涤晶体的目的______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方法中可以说明2HI(g)![]() H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
A. ②③⑤ B. ①④⑦ C. ②⑦⑨ D. ⑧⑨⑩
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
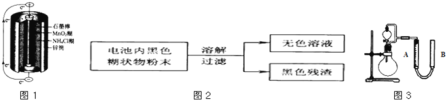
(1)锌锰干电池的负极电极反应式是 ______ ,电路中每通过0.4mol e-,负极质量减少 ______ g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是 ______ 。
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
实验步骤 | 实验现象 | 实验结论 |
①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量。 | 生成白色沉淀, ______ | 无色溶液中 存在Zn2+离子 |
② ______ | ______ | 无色溶液中 存在NH4+离子 |
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H2O2溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定)。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
实验二 | 足量MnO2 和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | ______ ______ |
①实验一、二中参加反应的H2O2的物质的量之比为 ______ ;
②实验二中反应的离子方程式为 ______ ;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意____ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中进行X2(g)+4Y2(g) ![]() 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别为:0.1 mol/L、0.4 mol/L、0.2 mol/L、0.3 mol/L,达到平衡,各物质的浓度不可能为( )
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别为:0.1 mol/L、0.4 mol/L、0.2 mol/L、0.3 mol/L,达到平衡,各物质的浓度不可能为( )
A.c(X2)=0.15 mol/LB.c(Y2)=0.9 mol/L
C.c(Z2)=0.3 mol/LD.c(Q2)=0.54 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】化学上常用燃烧法测定有机物的分子式,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
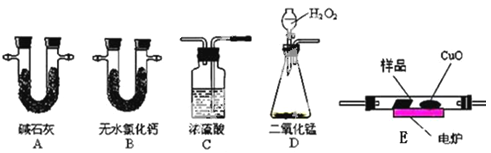
实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:___________(每种装置只用一次);
(2)实验数据记录和处理
物理量实验序号 | 燃烧有机物的质量 | ① | ② | ||
实验前质量 | 实验后质量 | 实验前质量 | 实验后质量 | ||
1 | m1 | m2 | m3 | m4 | m5 |
上表中①、②分别指哪个装置?____________ 、 _____________。
(3)若实验准确称取4.4 g样品,经燃烧后测得产生CO28.8 g,水蒸气3.6g。要确定该有机物的分子式,还必须知道的数据是________;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式___________,与该有机物相对分子质量相同的烃的一氯代物有_____种。
查看答案和解析>>
科目: 来源: 题型:
【题目】在四个相同的容器中,在不同的温度下(其它条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是( )
A.v(NH3)=0.1 mol /(Lmin)B.v(H2)=0.6 mol /(Lmin)
C.v(N2)=0.005 mol /(Ls)D.v(H2)=0.3 mol /(Lmin)
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定碱式碳酸钴[COx(OH)y(CO3)z]的化学组成,研究性学习小组的同学设计了如图所示的装置进行实验探究。已知:碱式碳酸钴受热时可分解生成三种氧化物。
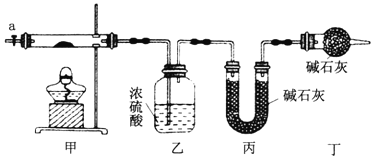
(1)按如图所示装置组装好仪器,并___________;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中_______(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是__________。
(2)某同学认为上述实验中存在一个缺陷,该缺陷是_________。
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为__________。
(4)CoCl2·6H2O常用作多彩水泥的添加剂。以含钴废料(含少量Fe、Al等杂质)制取COCl2·6H2O的一种工艺如下:
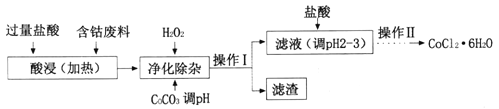
已知:25℃时
沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净化除杂时,加入H2O2发生反应的离子方程式为______________;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为_________;
③加盐酸调整pH为2~3的目的为___________;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)将下列性质的编号,填入各小题后面对应的横线中:
A.脱水性;B.强酸性;C.氧化性;D.吸水性
①将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。 ______
②在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。 ______
③在冷浓HNO3中放入铝片没明显现象. ______
④用稀硫酸清洗金属表面的氧化物。 ______
(2)矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的.此处所指的风化作用是指矿物与水和CO2同时作用的过程.例如钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此反应的离子方程式为:2KAlSi3O8 +2 CO2 +7H2O = 2K+ + 2HCO3-+ 4H2SiO3 + Al2Si2O5(OH)4,这个反应能够发生的原因是 ______ 。
(3)为了验证木炭和浓H2SO4反应生成的CO2、SO2,选用下图所示仪器(内含物质)组装成实验装置:(每组只能选一次,不能重复选)
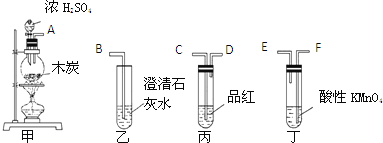
①如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):______ 接 ______ , ______ 接 ______ , ______ 接 ______ ;
②有怎样的实验现象才表明已检验出CO2? ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com