
科目: 来源: 题型:
【题目】肼(N2H4)碱性燃料电池的原理示意图如图所示,电池总反应为:N2H4+O2=N2+2H2O。下列说法错误的是( )
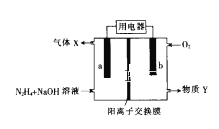
A.电极b发生氧化反应
B.电流由电极b流出经用电器流入电极a
C.物质Y是NaOH溶液
D.电极a的电极反应式为:N2H4+4OH--4e-=N2↑+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物M(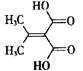 )是一种重要的化工原料。下列有关M的说法不正确的是( )
)是一种重要的化工原料。下列有关M的说法不正确的是( )
A.与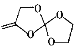 互为同分异构体
互为同分异构体
B.能使酸性高锰酸钾溶液褪色
C.能发生加成反应、取代反应和氧化反应
D.1 molM分别与足量的Na、NaHCO3溶液反应,产生气体的物质的量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
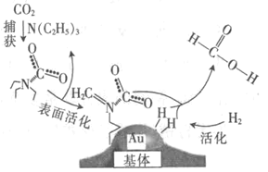
A.标准状况下,22.4 L CO2中所含的电子数目为16NA
B.10.1 g N(C2H5)3中所含的极性共价键数目为2.1NA
C.2 mol Au与2 mol H2中所含的分子数目均为2NA
D.100 g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式正确的是
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
科目: 来源: 题型:
【题目】煤、石油是人类目前使用的主要能源,同时也是重要的化工原料。
Ⅰ.石油经分馏、裂化、裂解可以获得C4H10、CH4、C3H6、C2H6、C2H4等许多重要的化工原料。
已知:i.C4H10(g)![]() CH4(g)+C3H6(g)
CH4(g)+C3H6(g)
ii.C4H10(g)![]() C2H6(g)+C2H4(g)
C2H6(g)+C2H4(g)
CH3CH2CH2CH3与![]() 的平衡转化率随温度变化的关系如图1所示。
的平衡转化率随温度变化的关系如图1所示。

(1)![]() 的名称是___;其一氯代物有___种,结构简式分别是___。
的名称是___;其一氯代物有___种,结构简式分别是___。
(2)660℃时,取1molCH3CH2CH2CH3通入2L恒容密闭容器中发生反应i、ii,经过30min达到平衡,C2H6的体积分数为![]() 。
。
①达平衡时反应物转化率为___,30min内,用C2H6表示的平均反应速率v(C2H6)为___。
②达到平衡时,CH4的物质的量分数为___%(精确到0.1)。
Ⅱ.用煤干馏得到的二甲苯和乙烯为原料合成涤纶(聚酯纤维)的路线如下:

(3)①写出A![]() B的化学方程式:__,反应类型是___。
B的化学方程式:__,反应类型是___。
②若1mol![]() 与1mol
与1mol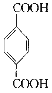 酯化反应的生成物中含两个环,写出该物质的结构简式:___;若生成物中只含一个环,写出反应的化学方程式___。
酯化反应的生成物中含两个环,写出该物质的结构简式:___;若生成物中只含一个环,写出反应的化学方程式___。
查看答案和解析>>
科目: 来源: 题型:
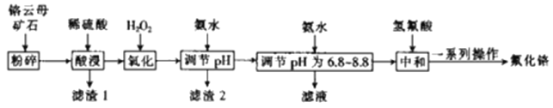
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
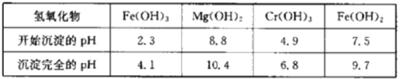
下表列出了相关金属离子生成氢氧化物沉淀的pH:
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有___种。
(2)将铬云母矿石粉碎的目的是___。
(3)滤渣1主要成分的用途是___。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___。
(5)第一次滴加氨水调节pH范围为___。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是___,Cr(OH)3与Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关反应热的描述正确的是![]()
![]()
A.稀![]() 与NaOH固体反应生成
与NaOH固体反应生成![]() 放出的热量为中和热
放出的热量为中和热
B.反应条件与反应所需活化能有关,与反应热无关
C.若一个反应的反应物总键能大于生成物总键能,则反应![]()
D.已知![]() 的燃烧热为
的燃烧热为![]() ,则完全燃烧
,则完全燃烧![]() 生成水蒸气放出的热量大于
生成水蒸气放出的热量大于![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸又名乙二酸,广泛存在于植物源食品中,它的用途非常广泛。测定某草酸晶体(组成为H2C2O4·nH2O)中H2C2O4的质量分数,进行下列实验:①取 w g 草酸晶体配成 250mL 溶液;②取 25.00mL 所配草酸溶液置于锥形瓶中, 加入适量稀H2SO4 后,在锥形瓶底部垫一张白纸,用浓度为 0.100mol·L-1KMnO4 溶液滴定。滴定时,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
请回答下列问题:
(1)上述反应的还原剂是_____(填化学式)。
(2)步骤①中为配制准确浓度的草酸溶液,所需用到的仪器有:天平(含砝码)、烧杯、药匙、250ml 容量瓶和___________ 、_______________。
(3)在锥形瓶底部垫一张白纸的作用是_____。
(4)滴定管应选用_______式滴定管(填“酸”或“碱”),判断滴定结束的标准是_________。
(5)三次滴定所用 KMnO 溶液体积平均为 20.00mL,则实验测得所配草酸溶液的物质的量浓度为______________mol·L-1;草酸晶体中 H2C2O4 的质量分数为_______________;在实验过程中,锥形瓶用蒸馏水洗净之后,再用草酸溶液润洗,对测定结果造成的影响是_______(填“偏大”、“偏小”或“无影响)
查看答案和解析>>
科目: 来源: 题型:
【题目】中医认为,明矾[KAl(SO4)2·12H2O]具有解毒杀虫,燥湿止痒,止血止泻,清热消痰的功效。实验室用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制取明矾的流程如下图所示。请回答下列问题:

(1)明矾溶于水后呈________性(填“酸”、“碱”或“中”);其原因是______(用离子程式表示)。
(2)明矾溶于水后所得的溶液中各离子浓度由大到小的顺序是__________。
(3)向明矾溶液中逐滴加Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH_____7(填“>”、“<”、“=”),离子反应总方程式为_________________
(4)为尽量少引入杂质,流程中的“试剂”应选用______________(填标号)。
A.NaCl溶液 B.KOH溶液 C.氨水 D.H2SO4溶液
(5)流程图中“沉淀”的化学式为_________________。
(6)已知:Kw=l.0×10-14,Al(OH)3![]() AlO2-+H++H2O,K=2.0×10-13:则Al(OH)3与NaOH溶液反应的平衡常数等于________________
AlO2-+H++H2O,K=2.0×10-13:则Al(OH)3与NaOH溶液反应的平衡常数等于________________
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是人类生活中最常见、应用最广泛的金属,钢铁在空气中很容易被腐蚀。
(1)炒过菜的铁锅未及时洗净(残液中含有 NaCl),不久便会因腐蚀而出现褐色锈斑。铁锅锈蚀的电极反应式为:负极___________________________,正极___________________________。
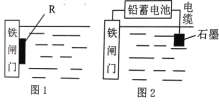
(2)为了降低某水库的铁闸门的腐蚀速率,可以采用图 1 所示的方案,其中焊接在铁闸门上的固体材料 R 可以采用 _______________ (填序号)。
A、铜 B、锌 C、钠 D、石墨
(3)图 2 所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在铅蓄电池的_______极上(填“正”或“负”)。
(4)常温下以铅蓄电池为电源,用石墨作电极电解 1L 0.1mol/L NaCl溶液,电解一段时间后,测得溶液的 pH 为 13,则铅蓄电池中转移电子的物质的量为__________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com