
科目: 来源: 题型:
【题目】元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期元素的第一电离能随原子序数的增大,总趋势逐渐增大。镓![]() 的基态电子排布式是_____,
的基态电子排布式是_____,![]() 的第一电离能明显低于
的第一电离能明显低于![]() ,原因是______。
,原因是______。
(2)多酚氧化酶与植物的抗病性有关。配合物![]() 是多酚氧化酶的模型配合物。
是多酚氧化酶的模型配合物。
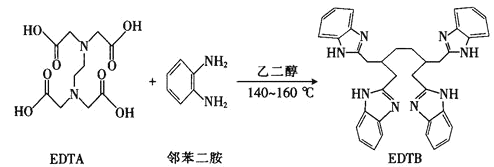
![]() 一个EDTA分子中
一个EDTA分子中![]() 键的数目为______________。
键的数目为______________。
![]() 分子中所含元素的电负性由小到大的顺序为______________________。
分子中所含元素的电负性由小到大的顺序为______________________。
![]() 与
与![]() 互为等电子体的一种阴离子为___________________。
互为等电子体的一种阴离子为___________________。
![]() 配离子
配离子![]() 中的配位原子是__________________。
中的配位原子是__________________。
(3)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,再向该溶液中加入乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是____________________________________________![]() 用相关的离子方程式和简单的文字说明加以解释
用相关的离子方程式和简单的文字说明加以解释![]() 。
。
(4)![]() 溶解在NaOH溶液中,可得到钒酸钠
溶解在NaOH溶液中,可得到钒酸钠![]() ,该盐阴离子中V的杂化轨道类型为______________;也可以得到偏钒酸钠,其阴离子呈如图1所示的无限链状结构,则偏钒酸钠的化学式为_________________________。
,该盐阴离子中V的杂化轨道类型为______________;也可以得到偏钒酸钠,其阴离子呈如图1所示的无限链状结构,则偏钒酸钠的化学式为_________________________。

(5)钒的某种氧化物晶胞结构如图2所示。该氧化物的化学式为_____________,若它的晶胞参数为![]() ,则晶胞的密度为__________
,则晶胞的密度为__________![]() 写计算式
写计算式![]() 。
。

查看答案和解析>>
科目: 来源: 题型:
【题目】锗在自然界中非常分散,几乎没有比较集中的锗矿,因此被人们称为“稀散金属”。回答下列问题:
(1)基态锗原子最外层电子排布图为_______,Ge原子的电子发生跃迁时会吸收或放出不同的光,可用_______![]() 填仪器名称
填仪器名称![]() 摄取其原子光谱,从而鉴定Ge元素的存在。
摄取其原子光谱,从而鉴定Ge元素的存在。
(2)锗元素能形成无机化合物![]() 如锗酸钠:
如锗酸钠:![]() ;二锗酸钠:
;二锗酸钠:![]() ;四锗酸钠:
;四锗酸钠:![]() 等
等![]() ,也能形成类似于烷烃的锗烷
,也能形成类似于烷烃的锗烷![]() 。
。
![]() 中锗原子的杂化方式为______________。
中锗原子的杂化方式为______________。
![]() 锗与碳同族,性质及结构有一定的相似性,据此推测
锗与碳同族,性质及结构有一定的相似性,据此推测![]() 二锗酸钠
二锗酸钠![]() 中含有的
中含有的![]() 键的数目为_________。
键的数目为_________。
![]() 至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因:___________________。
至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因:___________________。
化学键 |
|
|
|
|
键能 | 346 | 411 | 188 | 288 |
(3)有机多元膦酸锗配合物是由![]() Ⅳ
Ⅳ![]() 与
与![]() 形成的,其结构如下:
形成的,其结构如下:
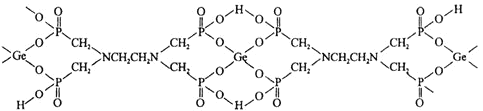
![]() 该配合物中,下列作用力不存在的有_________
该配合物中,下列作用力不存在的有_________
A.极性键 ![]() 非极性键
非极性键 ![]() 金属键
金属键 ![]() 配位键
配位键 ![]() 氢键
氢键 ![]() 键
键
![]() 该配合物中
该配合物中![]() Ⅳ
Ⅳ![]() 的配位数是_______;配位原子是_______
的配位数是_______;配位原子是_______![]() 填元素符号
填元素符号![]() 。
。
![]() 试解释磷酸
试解释磷酸![]() 酸性为什么与亚硝酸相近?______________。
酸性为什么与亚硝酸相近?______________。
(4)![]() 常作为军事上的红外制导材料,其理想晶胞如图所示。测得晶胞参数
常作为军事上的红外制导材料,其理想晶胞如图所示。测得晶胞参数![]() ,
,![]() ,该晶体的密度为_______
,该晶体的密度为_______![]() 列出算式即可,阿伏加德罗常数用
列出算式即可,阿伏加德罗常数用![]() 表示
表示![]() 。
。

![]() 原子的分数坐标即将晶胞参数a、b、c均看作“1”所得出的三维空间坐标,以1号Zn为坐标原点,则
原子的分数坐标即将晶胞参数a、b、c均看作“1”所得出的三维空间坐标,以1号Zn为坐标原点,则![]() 晶胞图中标号为“2”的P原子的分数坐标为_______。
晶胞图中标号为“2”的P原子的分数坐标为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3的物质的量变化如图所示。

(1)反应处于平衡状态的时间段是_________________。
(2)图中10~20 min内曲线发生变化的可能原因是_______________________________________。
(3)第25 min,平衡改变的条件是____________________________________,此时正反应速率_____(填“增大”“减小”或“不变”);重新达平衡后,NH3的体积分数比原平衡______(填“大”“小”或“不变”)。
(4)判断该反应达到平衡状态的标志是___________(填字母)。
a.N2和NH3的浓度相等
b.NH3的百分含量保持不变
c.容器中气体的压强不变
d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应.实验室常用
是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应.实验室常用![]() 标准溶液标定未知浓度的
标准溶液标定未知浓度的![]() 溶液,发生反应
溶液,发生反应![]() ↑.
↑.
根据以上信息,完成下列问题:
(1)按电子排布K位于元素周期表的________区,基态![]() 的核外电子排布式可表示为________.
的核外电子排布式可表示为________.
(2)![]() 中所含有的共价键数目为________.
中所含有的共价键数目为________.
(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为________,![]() 中碳原子的轨道杂化类型是________.
中碳原子的轨道杂化类型是________.
(4)同主族元素氧、硫、硒对应最简单氢化物的沸点:![]() ,原因是________.
,原因是________.
(5)![]() 的结构中Se为面心立方最密堆积,晶胞结构如图所示.
的结构中Se为面心立方最密堆积,晶胞结构如图所示.
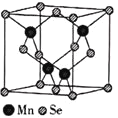
![]() 中Mn的配位数为________.
中Mn的配位数为________.
![]() 若该晶体的晶胞参数为apm,阿伏加德罗常数的值为
若该晶体的晶胞参数为apm,阿伏加德罗常数的值为![]() 则距离最近的两个锰原子之间的距离为________pm,
则距离最近的两个锰原子之间的距离为________pm,![]() 的密度
的密度![]() ________
________![]() 列出表达式
列出表达式![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
I | 0.6 | 0 | 0 | 0.2 |
II | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 达平衡时,容器I与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器中Ⅱ中 c(O2)/ c(NO2) 比容器I中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为 T2时,若 k正=k逆,则 T2<T1
查看答案和解析>>
科目: 来源: 题型:
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固溶体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。
(1)基态钴原子的价电子排布图为___________。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体(如下图)。科学研究表明,顺式分子具有抗癌活性。

①吡啶分子是大体积平面配体,其结构简式如图所示![]() 。每个吡啶分子中含有的σ键数目为___________。吡啶分子中所含的各元素的电负性由大到小的顺序是___________。
。每个吡啶分子中含有的σ键数目为___________。吡啶分子中所含的各元素的电负性由大到小的顺序是___________。
②二氯二吡啶合铂中存在的微粒间作用力有___________(填字母)。
a.范德华力 b.氢键 c.金属键 d.非极性键
③反式二氯二吡啶合铂分子是___________(填“极性分子”或“非极性分子”)。

(3)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如下图所示。
①“分子金属”可以导电,是因为___________能沿着其中的金属原子链流动。

②“分子金属”中,铂原子是否以sp3的方式杂化?_________(填“是”或“否”),其理由是_______。
(4)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿x、y或z轴的投影图如图所示。若金属铂的密度为dg·cm-3,则晶胞参数a=______nm(列计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】B和Mg在材料科学领域有广泛的应用和发展前景。
回答下列问题:
(1)下列B原子轨道表达式表示的状态中,能量更高的是________![]() 填“A”或“B”
填“A”或“B”![]() 。
。
A. ![]() B.
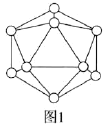
B. ![]()
(2)晶体硼中的基本单元如图1所示,其中含有12个B原子。![]() 该单元中含有
该单元中含有![]() 键的数目为________。
键的数目为________。
(3)![]() 是重要的还原剂。其中阴离子的立体构型为________,中心原子的杂化形式为________。
是重要的还原剂。其中阴离子的立体构型为________,中心原子的杂化形式为________。
(4)基态Mg原子的核外电子排布式为________;第三周期主族元素中,电负性小于Mg元素的有________![]() 填元素符号,下同
填元素符号,下同![]() ,原子第一电离能小于Mg原子的有________。
,原子第一电离能小于Mg原子的有________。
(5)![]() 和
和![]() 均可作为耐火材料,其原因是________。
均可作为耐火材料,其原因是________。
(6)![]() 常用于光学仪器,其长方体型晶胞结构如图2所示:
常用于光学仪器,其长方体型晶胞结构如图2所示:
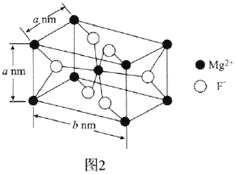
![]() 的配位数为________。
的配位数为________。
![]() 若阿伏加德罗常数的值为
若阿伏加德罗常数的值为![]() ,则
,则![]() 晶体的密度可表示为________
晶体的密度可表示为________![]() 用含a、b、
用含a、b、![]() 的代数式表示
的代数式表示![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】由N、F、S、Cl、Cu、Ni等元素组成的物质在生产、生活中有着广泛的用途,回答下列问题.
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序但有严格准周期位置序的独特晶体.可通过________方法区分晶体、准晶体和非晶体,![]() 四氟乙烯分子中含
四氟乙烯分子中含![]() 键数目为________.
键数目为________.
(2)![]() 原子的价层电子轨道表达式
原子的价层电子轨道表达式![]() 价层电子排布图
价层电子排布图![]() 为________.
为________.
(3)![]() 、Cl、S电负性由大到小的顺序为________.
、Cl、S电负性由大到小的顺序为________.
(4)![]() 氟酸锑
氟酸锑![]() 是一种超强酸,离子
是一种超强酸,离子![]() 的空间构型为________,依次写出一种与
的空间构型为________,依次写出一种与![]() 具有相同空间构型和键合形式的分子和阴离子:________、________.
具有相同空间构型和键合形式的分子和阴离子:________、________.
(5)![]() 氟化铵
氟化铵![]() 可用作玻璃蚀刻剂、防腐剂、消毒剂等.
可用作玻璃蚀刻剂、防腐剂、消毒剂等.![]() 的中心原子的杂化类型是________;氟化铵中存在________
的中心原子的杂化类型是________;氟化铵中存在________![]() 填字母
填字母![]() .
.
A.离子键
B.![]() 键
键
C.![]() 键
键
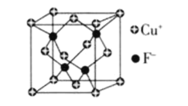
(6)![]() 的密度为
的密度为![]() ,CuF的晶胞结构如下图.CuF的晶胞参数
,CuF的晶胞结构如下图.CuF的晶胞参数![]() ________
________![]() 列出计算式
列出计算式![]() .
.
查看答案和解析>>
科目: 来源: 题型:
【题目】氮族元素的单质及其化合物在生活、生产中有广泛应用。
(1)下列电子排布图能表示基态N原子的电子排布情况的是________![]() 填代号
填代号![]() 。
。
A. 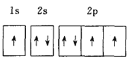 B.
B. 
C. 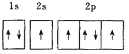 D.
D. 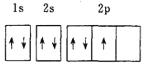
(2)键角:![]() ,从原子结构角度分析原因:__________________。
,从原子结构角度分析原因:__________________。![]() 中As原子的杂化类型是_____________,空间构型是_______________。
中As原子的杂化类型是_____________,空间构型是_______________。
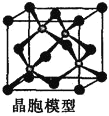
(3)白磷中毒后,用硫酸铜溶液解毒,其化学反应原理如下:![]()
![]() 白磷的结构如图所示,上述反应转移
白磷的结构如图所示,上述反应转移![]() 电子时,破坏
电子时,破坏![]() ______
______![]() 键。与
键。与![]() 中阴离子互为等电子体的分子有______
中阴离子互为等电子体的分子有______![]() 填一种即可
填一种即可![]() 。
。

![]() 中铜离子的价层电子排布式为_____________________。
中铜离子的价层电子排布式为_____________________。
![]() 在
在![]() 溶液中滴加过量氨水生成蓝色溶液,主要成分是
溶液中滴加过量氨水生成蓝色溶液,主要成分是![]() ,它不含的作用力类型有_______。
,它不含的作用力类型有_______。![]() 填代号
填代号![]()
![]() 离子键
离子键 ![]() 金属键
金属键 ![]() 配位键
配位键 ![]() 极性共价键
极性共价键
(4)联氨![]() 的沸点为
的沸点为![]() ,联磷
,联磷![]() 的沸点为
的沸点为![]() ,其主要原因是_____________。
,其主要原因是_____________。
(5)磷化硼是半导体材料,早在1891年,法国化学家亨利![]() 莫瓦桑就合成了磷化硼晶体,其晶胞如图所示。磷化硼的化学式为______________。磷化硼的熔点为
莫瓦桑就合成了磷化硼晶体,其晶胞如图所示。磷化硼的化学式为______________。磷化硼的熔点为![]() ,它的晶体类型是______________。
,它的晶体类型是______________。
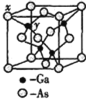
(6)砷化镓是重要的半导体材料,用来制作半导体激光器和太阳电池等元件。砷化镓晶胞如图所示。已知砷化镓的摩尔质量为![]() ,密度为
,密度为![]() ,
,![]() 代表阿伏加德罗常数的值。图中x和y最短核间距离为____________________pm。
代表阿伏加德罗常数的值。图中x和y最短核间距离为____________________pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法中正确的是![]()

A.图中A、B、D三点处![]() 的大小关系:
的大小关系:![]()
B.若处在B点,将![]() 的硫酸与
的硫酸与![]() 的KOH溶液等体积混合,溶液显中性
的KOH溶液等体积混合,溶液显中性
C.![]() 时,保持温度不变,在水中加入适量
时,保持温度不变,在水中加入适量![]() 固体,体系可从A点变化到C点
固体,体系可从A点变化到C点
D.A点所对应的溶液中,可同时大量存在![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com