
科目: 来源: 题型:
【题目】NO、NO2是汽车尾气中主要的含氮氧化物。回答下列问题:
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2molNO2的能量变化)。1molNO氧化为NO2的焓变ΔH=___。

(2)某温度下,反应的平衡常数如下:
a.2NO2(g)N2(g)+2O2(g) K=6.7×1016
b.2NO(g)N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是___(填“a”或“b”);反应2NO(g)+O2(g)2NO2(g)的K=___(保留三位有效数字)。
(3)已知反应2NO(g)+O2(g)2NO2的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
起始浓度/molL-1 | |||
组别 | NO | O2 | 初始速率 /molL-1s-1 |
1 | 0.02 | 0.0125 | 7.98×10-3 |
2 | 0.02 | 0.0250 | 15.96×10-3 |
3 | 0.04 | 0 0125 | 31.92×10-3 |
则k1=___,m=___,n=___。
(4)已知该反应的历程为:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列叙述正确的是___(填字母)。
A.第一步反应的平衡常数K=![]()
B.v(第一步的正反应)<v(第一步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
(5)一定条件下测得容器中NO、O2、NO2浓度发生如图变化。

①NO的平衡转化率为___。
②该温度下反应2NO(g)+O2(g)2NO2(g)的平衡常数为___(保留整数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为___。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ/mol;2NO(g)+O2(g)
2SO3(g) ΔH=-196.6kJ/mol;2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0kJ/mol;
2NO2(g) ΔH=-113.0kJ/mol;
①则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH的ΔH=___kJ/mol。
SO3(g)+NO(g) ΔH的ΔH=___kJ/mol。
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1molSO3的同时生成1molNO2
③测得上述反应平衡时NO2与SO2的体积比为1:6,则平衡常数K=___。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g),ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g),ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
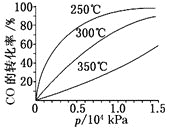
该反应ΔH___0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机物说法不正确的是( )
A.![]() 的名称为2-甲基-1,3-二丁烯
的名称为2-甲基-1,3-二丁烯
B.含8个碳原子的有机物,每个分子中可能形成8个C—C单键
C.![]() 属于芳香烃且属于苯的同系物
属于芳香烃且属于苯的同系物
D.沸点比较:乙二醇>乙醇>乙烷
查看答案和解析>>
科目: 来源: 题型:
【题目】航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g)
(1)将原料气按![]() ∶
∶![]() =1∶4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
=1∶4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
① 该反应的平衡常数K随温度升高而__________(填“增大”或“减小”)。

② 温度过高或过低均不利于该反应的进行,原因是________。
③ 200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是______(填标号)。
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3)一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)![]() C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
① 已知CO2(g)、H2O(g)的生成焓分别为–394 kJmol-1、–242 kJmol-1,Bosch反应的ΔH =________kJmol-1。(生成焓指一定条件下由对应单质生成1mol化合物时的反应热)
② 一定条件下Bosch反应必须在高温下才能启动,原因是________。
③ 新方案的优点是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】G是一种治疗急慢性呼吸道感染的特效药中间体,其制备路线如图:

(1)化合物C中的含氧官能团是_____。
(2)A→B的反应类型是______。
(3)化合物F的分子式为C14H21NO3,写出F的结构简式______。
(4)从整个制备路线可知,反应B→C的目的是______。
(5)同时满足下列条件的B的同分异构体共有_______种。
①分子中含有苯环,能与NaHCO3溶液反应;
②能使FeCl3溶液显紫色
(6)根据已有知识并结合相关信息,完成以![]() 、CH3NO2为原料制备
、CH3NO2为原料制备 的合成路线图____(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线图____(无机试剂任用,合成路线流程图示例见本题题干)。
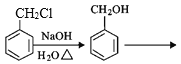
 ,其中第二步反应的方程式为_____。
,其中第二步反应的方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O35H2O,M=248g/mol)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体,具体流程如图:

回答下列问题:
(1)吸硫装置如图所示。装置B的作用是检验装置A中SO2的吸收效率,表明SO2吸收效率低的实验现象是_____。

(2)市售硫代硫酸钠中常含有硫酸钠杂质,选用下列试剂设计实验方案进行检验:试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液、无氧蒸镏水,完成下列操作:
实验操作 | 现象 | 结论 |
取少量样品于试管中,加入无氧蒸馏水 | 固体完全溶解 | |
往试管中加入_____ | _______,有刺激性气体产生 | 试样中含有硫代硫酸钠 |
静置,取上层清液,滴加_______ | ______________ | 试样含有硫酸根 |
(3)测定硫代硫酸钠的纯度步骤如下:
①溶液配制:准确取5.0000g产品,配制成250mL溶液,配制溶液的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除_____及二氧化碳。
②滴定:向锥形瓶中加入25.00mL0.01mol/LKIO3溶液,加入过量KI溶液和H2SO4溶液,发生反应:IO3-+5I-+6H+ =3I2+3H2O,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定,发生反应:I2+2S2O32-=S4O62-+2I-。当_____,即为终点。消耗样品溶液的用量为20.00mL,则样品纯度为_____%(保留4位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq)![]() HOI(aq) △H2
HOI(aq) △H2
③HOI(aq)+I-(aq)+H+(aq)![]() I2(aq)+H2O(l) △H3
I2(aq)+H2O(l) △H3
总反应的热化学方程式为___。
(2)AgCl和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:写出白色固体转化成黑色固体的化学方程式:___。
(3)向Na2CO3溶液中滴加酚酞呈红色的原因是___(用离子方程式表示);溶液中各离子浓度由大到小的顺序___;向此溶液中加入AlCl3溶液,观察到的现象是__,反应的离子方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】磺酰氯(SO2C12)主要用作氯化剂或氯磺化剂,熔、沸点分别为-54.1°C和69°C,在空气中遇水蒸气发生剧烈反应产生大量白雾。某实验室用干燥的SO2和Cl2 通入如图装置乙(省略夹持装置)制取磺酰氯。回答下列问题:

(1)组合装置甲的作用是制取干燥纯净的氯气,仪器连接的正确顺序是e→____,____→____,____→g。
(2)为提高实验中磺酰氯的产率,实验中可采取的措施有_______(只答一条即可)
(3)实验时在导管口f接一装置,该装置为________(填标号)。

(4)SO2C12遇水蒸气反应的化学方程式为________。
(5)反应结束后,安装好蒸馏装置,把三颈烧瓶中的物质和沸石加入到蒸镏烧瓶中,接下来的操作是先_______,然后_______,弃去前馏分,收集69℃的馏分,得到磺酰氯粗品。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在一定条件下xA+yB![]() zC达到平衡时,请填写:
zC达到平衡时,请填写:
①若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是___。
②已知B、C是气体,现增加A的物质的量,平衡不移动,说明A是___(填状态)。
③若容器容积不变,加入气体B,气体A的转化率___(填“增大”“减小”或“不变”)。
④若加热后,C的百分含量减小,则正反应是___反应(填“放热”或“吸热”)。
⑤和原平衡相比,加催化剂达到平衡时,气体A的转化率___(填“增大”“减小”或“不变”)。
⑥若容器容积不变,且A、B、C都是气体,向容器中充入稀有气体,则___。
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不移动 D.反应停止
(2)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=____。

②下列说法正确的是___(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
③甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应中的能量变化是人类获取能量的重要途径。
(1)液化气是一种重要的家庭燃料,下列示意图与液化气在燃烧过程中的能量变化最相符的是___
A.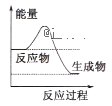 B.
B. C.
C.
(2)人们普遍使用的干电池工作时是将化学能转化为___。
(3)已知拆开1molH2中的化学键要吸收436kJ的能量,拆开1molO2中的化学键要吸收496kJ的能量,形成水分子中的1molH—O键要放出463 kJ的能量,试计算2H2+O2=2H2O反应中的ΔH=___kJ·mol-1。
(4)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:

①电极X的材料是___;电解质溶液Y是___;
②银电极为电池的___极,发生的电极反应为___;X电极上发生的电极反应为___;
③如果闭合电路前X电极与银电极质量相等,当电路中通过0.1mol电子时,两电极质量差为___g。(原子量Cu:64;Ag:108)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com