
科目: 来源: 题型:
【题目】常温下,在![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示
溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示![]() 因逸出未画出,忽略因气体逸出引起的溶液体积变化
因逸出未画出,忽略因气体逸出引起的溶液体积变化![]() ,下列说法正确的是
,下列说法正确的是![]()
![]()
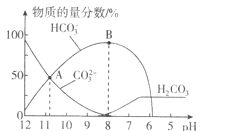
A.在![]() 溶液中:
溶液中:![]()
B.当溶液的pH为7时,溶液的总体积为![]()
C.在B点所示的溶液中,离子浓度最大的是![]()
D.在A点所示的溶液中:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】有一铁的氧化物样品,用140 mL 5 mol·L-1的盐酸恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为
A.Fe2O3B.Fe3O4C.Fe4O5D.Fe5O7
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关.
(1)下列生活用品中,其主要材料属于天然纤维的是_________(填字母序号);
A.塑料保鲜薄 B.橡胶手套 C.棉布围裙
(2)我们常用的洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_________的功能;
(3)食用水果、蔬菜主要补充人体所需的_________;
(4)国家禁止在面粉中添加增白剂过氧化钙CaO2,过氧化钙中氧元素的化合价为_______;
(5)农业上降低土壤酸性的是_________(填化学式);
(6)生活中要用到大量的钢铁,写出赤铁矿(主要成分Fe2O3)冶炼成铁的化学方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法中正确的是 ( )
A.1L 1mol·L-1的CH3COOH溶液中含有NA个氢离子
B.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
C.0.1mol金属钠在过量氧气充分燃烧,生成的化合物中离子总数为0.15NA
D.VL CO和NO的混合气体中含有的氧原子个数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)![]() 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
查看答案和解析>>
科目: 来源: 题型:
【题目】以环已醇( ![]() )为原料制取己二酸[HOOC(CH2)4COOH]的实验流程如下:
)为原料制取己二酸[HOOC(CH2)4COOH]的实验流程如下:
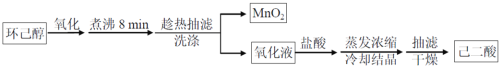
其中“氧化”的实验过程:在250mL四口烧瓶中加入50mL水和3.18g碳酸钠,低速搅拌至碳酸钠溶解,缓慢加入9.48g(约0.060mol)高锰酸钾,按图示搭好装置,打开电动搅拌,加热至35℃,滴加3.2mL(约0.031mol)环己醇,发生的主要反应为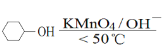 KOOC(CH2)4COOK ΔH<0
KOOC(CH2)4COOK ΔH<0
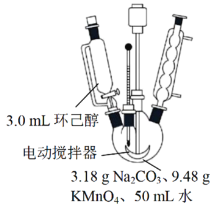
(1)“氧化”过程应采用___________加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
(2)“氧化”过程,不同环己醇滴加速度下,溶液温度随时间变化曲线如图,为保证产品纯度,应选择的滴速为___________s/滴。
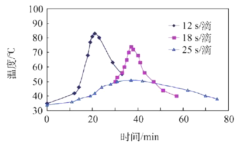
(3)为证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到_____,则表明反应已经完成.
(4)“趁热抽滤”后,用________进行洗涤。
(5)室温下,相关物质溶解度如表。“蒸发浓缩”过程中,为保证产品纯度及产量,应浓缩溶液体积至__(填标号)。
化学式 | 己二酸 | NaCl | KCl |
溶解度g/100g 水 | 1.44 | 35.1 | 33.3 |
A.5mL B. 10mL C. 15mL D. 20mL
(6)称取已二酸(Mr=146g/mol)样品0.2920g,用新煮沸的50mL热水溶解,滴入2滴酚酞试液,用0.2000 mol/LNaOH溶液滴定至终点,进行平行实验及空白实验后,消耗NaOH的平均体积为19.70mL.
①NaOH溶液应装于_______ (填仪器名称).
②己二酸样品的纯度为___________.
查看答案和解析>>
科目: 来源: 题型:
【题目】硫及其化合物在工农业生产中有着重要作用.回答下列问题
(1)工业制硫酸,接触室中发生反应的化学方程式为___________。下列可提高SO2平衡转化率的措施是___________。(填标号)
A.降低温度 B.减小压强 C.延长反应时间 D.增大O2的投料
(2)工业上可用Fe2(SO4)3溶液吸收SO2,该过程的离子方程式为________。为实现吸收液的再生,可通入_________。
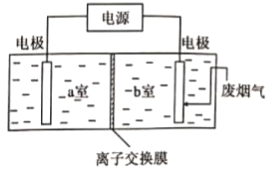
(3)用如图装置脱除废烟气中的SO2和废水中的Cu2+,该方法总反应的化学方程式为___________。含Cu2+的废水应置于___________室(填“a”或“b”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是_______________________________________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式。
C6H12O6(葡萄糖)![]() 2________+2C2H5OH
2________+2C2H5OH
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是________________________________。
②试管b中盛放的试剂是饱和_________________溶液。
⑧实验开始时,试管b中的导管不伸入液面下的原因是___________________。
④若分离出试管b中生成的乙酸乙酯,需要用到的仪器是____(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
查看答案和解析>>
科目: 来源: 题型:
【题目】化学环分解氯化铵的纯碱和氯乙烯集成清洁工艺如下:
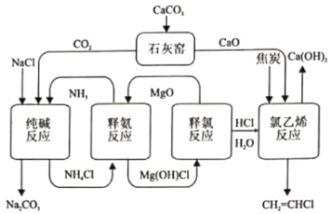
(1)“释氨反应”步骤可能发生的化学反应:
NH4Cl(s)≒ NH3(g)+HCl(g) ΔH=163.57 kJ/mol
MgO(s)+ HCl(g) ≒ MgOHCl(s) ΔH=-102.23 kJ/mol
则总反应NH4Cl(s)+MgO(s)≒NH3(g)+MgOHCl(s) ΔH=____kJ/mol
(2)“释氯反应”可能的化学反应有:
i. MgOHCl(s)≒MgO(s)+ HCl(g) ΔH=+97.50 kJ/mol
ii. MgOHCl(s)+ HCl(g)≒MgCl2(s)+H2O(g) ΔH=+2.89 kJ/mol
iii. MgCl2(s)+ H2O(g)=MgO(s)+2HCl(g) ΔH=+94.61 kJ/mol
图为“释氯反应”在不同温度下各组分的平衡组成,回答下列问题
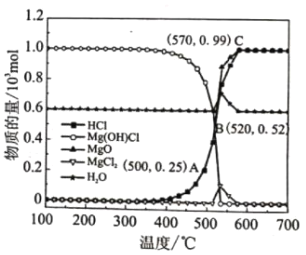
①应选择的最佳反应温度是___________
②500°C时,释氯反应器的压强为P,计算该温度下反应i的平衡常数Kp=___________ (Kp为以分压表示的平衡常数)
③结合平衡移动原理,原料气增加水蒸气的目的是___________
(3)“氯乙烯反应”中,![]() (g)+HCl(g)
(g)+HCl(g)![]() CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
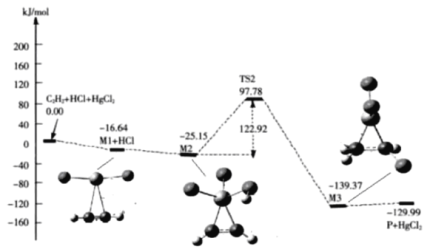
①碳碳叁键的键能:M1_____ ![]() (填“>”或“<”)
(填“>”或“<”)
②“M2→M3”的化学方程式为__________
③该反应的决速步骤为__________
(4)下列有关该工艺的说法不正确的是______(填标号)
A.可循环利用的物质有NH3、MgO、HCl
B.“石灰窑”和“纯碱反应”的副产物可实现资源化利用
C.利用MgO作为吸附剂可有效实现NH3与HCl分离
D.减少了从氯碱工业的产品获取HCl的电能消耗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com