
科目: 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:

已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+。
③离子浓度≤10-5mol·L-1时,离子沉淀完全。请回答下列问题:
(1)为提高“酸溶”时镍元素的浸出率,所采取的的措施为____(写1种)。
(2)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为_______。
(3)“氨解”的目的为__ “氨解”时需要控制低温原因是______。
(4)“氧化”时发生反应的化学方程式为_____。
(5)“二次碱浸”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于_____。(已知:Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(6)若在流程中完成“系列操作”。则下列实验操作中,不需要的是____(填下列各项中序号)。




查看答案和解析>>
科目: 来源: 题型:
【题目】高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含 Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:

回答下列问题:
(1)浸出时,为了提高浸出效率采取的措施有(写两种):__________;
(2)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn元素全 部转化为MnO2),请配平下列除去Fe2+的离子方程式:
______MnO4-+______Fe2++_____=______MnO2↓+______Fe(OH)3↓+______H+
(3)加入锌粉的目的是_____________________。
(4)已知H2SO4浸出液中,c(Fe2+)=5.04mg/L、c(Mn2+) ="1." 65mg/L。
①加入KMnO4溶液反应一段时间后,溶液中c(Fe3+) ="0." 56 mg/L,若溶液pH=3,则此时Fe3+_________(填“能”或“不能”)发生沉淀。
②若要除尽1m3上述浸出液中的Fe2+和Mn2+,需加入________g KMnO4。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:
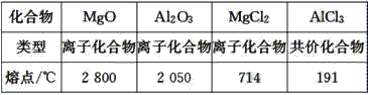
工业制镁时,电解MgCl2而不电解MgO的原因是__________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。

(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是
A. 反应后生成的盐只为Fe(NO3)3
B. 反应后生成的盐只为Fe(NO3)2
C. 反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3
D. 反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M 均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去)。下列说法中不正确的是( )
![]()
A.若 M 是单质铁,则 Z 溶液可能是 FeCl2 溶液
B.若 M 是氢氧化钠,则 X 水溶液呈酸性
C.若 M 是氧气,则 X、Z 的相对分子质量可能相差 48
D.若 M 是强氧化性的单质,则 X 可能是金属铝
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钾的冶炼可采用如下方法:2KF+CaC2![]() CaF2+2K↑+2C,下列有关说法合理的是( )
CaF2+2K↑+2C,下列有关说法合理的是( )
A.该反应的氧化剂是KF,氧化产物是K
B.该反应能说明C的还原性大于K
C.电解KF溶液不可能制备金属钾
D.CaC2、CaF2均为离子化合物,且阴、阳离子个数比均为2∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】某盐溶液NaHR的电离方程式为NaHR=Na++HR-下列有关说法不正确的是
A.Na2R溶液的pH值一定大于7
B.若NaHR溶液中c( OH-)>c( R2-)则溶液呈碱性
C.c(Na+)>c(HR-)>c( R2-)>c(OH-)>c( H+)
D.NaHR溶液的pH值不一定大于7
查看答案和解析>>
科目: 来源: 题型:
【题目】有一无色透明溶液,欲确定是否含有下列离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,取该溶液的实验如下:
,取该溶液的实验如下:
实验步骤 | 实验现象 |
| 溶液变红色 |
| 有无色气体产生,气体遇空气可以变成红棕色 |
| 有白色沉淀生成 |
| 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断,下列说法正确的是![]()
A.根据实验![]() 可以确定溶液中不含有
可以确定溶液中不含有![]() 和
和![]() ,因为这二个离子相对应的酸为弱酸
,因为这二个离子相对应的酸为弱酸
B.溶液中一定存在的离子是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ;溶液中肯定不存在的离子是:
;溶液中肯定不存在的离子是:![]() 、
、![]() 、
、![]() 、
、![]()
C.为进一步确定其它离子,应该补充焰色反应的实验来检验![]() 就可以
就可以
D.通过实验![]() 和
和![]() 就可以确定溶液中一定含有
就可以确定溶液中一定含有![]() ,一定不含有
,一定不含有![]() 、
、![]() 、
、![]() ,所以实验步骤
,所以实验步骤![]() 的设计是错误的
的设计是错误的
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(![]() )、c(H+)均减小
)、c(H+)均减小
B.常温下,c(![]() )相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③
)相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③
C.pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)<c(NaHCO3)<c(Na2CO3)
D.某温度时水的离子积常数KW=10-13,若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液pH=2,则a∶b=2∶9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com